心肌梗死相关研究新进展
心肌梗死(MI)是心脏病发作事件的一个术语。当血液停止正常流向心脏的某个部位时,心肌就会因为缺氧而受伤。其原因是为心脏供血的冠状动脉由于斑块、白细胞、胆固醇和脂肪的不稳定积聚而发生堵塞。如果病情严重,则称为“急性”心肌梗死(AMI)。由于成年心肌细胞几乎没有再生能力,MI中受损的心肌组织被纤维化组织所取代,导致心功能不全和心力衰竭(HF)。近期,多篇文献报道了MI后心肌细胞修复相关研究,可能为心脏疾病的预防和治疗提供帮助。
1. 直接重新编程改善慢性MI患者的心脏功能并逆转纤维化
MI后,常驻心脏成纤维细胞(CF)合成细胞外基质,形成纤维化,导致心脏功能障碍和HF。日本筑波大学医学部心内科Masaki Ieda团队使用过表达心脏转录因子[Mef2c/Gata4/Tbx5/Hand2(MGTH)]小鼠研究心脏重编程事件对慢性MI的影响[1]。过表达MGTH,可以直接将CF重新编程为诱导心肌细胞(iCM),显著改善慢性MI的心肌收缩并减少纤维化。单细胞RNA测序显示,驻留的CF由7个亚簇组成,在慢性MI下,纤维化CF群体增加。心脏重编程通过将纤维化CF转化为静止的抗纤维化状态来抑制慢性MI中的CF基因表达(图1)。MGTH过表达部分通过抑制Meox1(CF激活的中枢调节因子)诱导抗纤维化作用。这些结果表明,心脏重编程可以通过心肌再生和减少纤维化来修复慢性MI,为开发治疗慢性MI和HF的新疗法提供帮助。
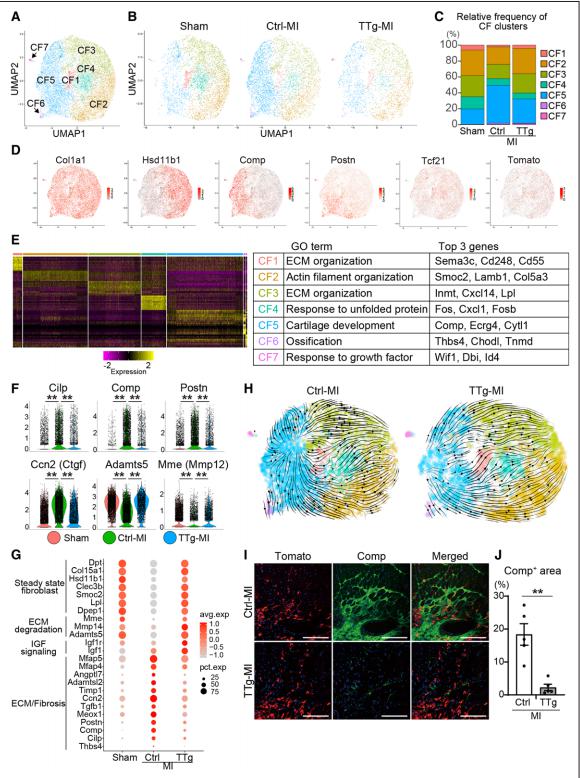
图1.心脏重编程使慢性MI的CF转变为静止状态
2. 过度的支链氨基酸积累限制了间充质干细胞治疗MI的疗效
输送到缺血后心脏环境中的间充质干细胞(MSC)的存活率和保留率较低,因此限制了基于MSC治疗的心脏修复效果。第四军医大学西京医院心内科Ling Tao团队发现过多的支链氨基酸(BCAA)积累,不利于心肌内注射的MSC的保留和心脏保护[2]。病理水平的BCAA通过加速组蛋白3赖氨酸9三甲基化(H3K9me3)的丢失,使MSC对应激诱导的细胞死亡和早衰敏感。mTORC1/DUX4/KDM4E轴被鉴定为BCAA诱导的H3K9me3丢失和不良表型获得的原因(图2)。通过遗传/药理学方法增强MSC的BCAA分解代谢能力,大大提高了它们对高BCAA环境的适应能力,并增强了它们的心脏保护作用。这些结果提示通过适当的途径增强MSC中的BCAA分解代谢可能是改善MSC对缺血心肌环境的适应性的可行策略,因此可以优化基于MSC的治疗的心脏修复效果。
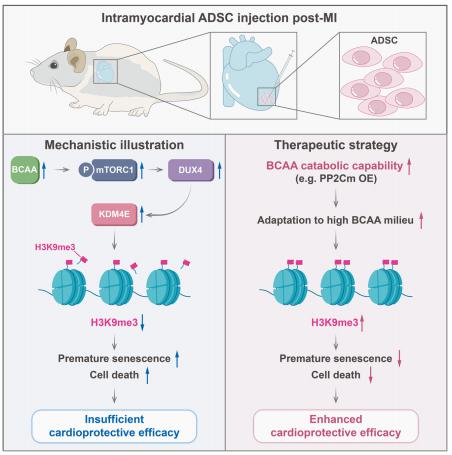
图2.过度的支链氨基酸积累限制了间充质干细胞治疗MI的疗效
3. 新型心肌细胞因子GDF3预测MI后不良纤维重塑
法国巴黎心血管研究中心Jean-Sébastien Hulot探讨了MI后CF的扩张是否可以通过心肌基质细胞的旁分泌作用来调节[3]。MI后心脏基质PW1+细胞旁分泌行为发生改变,这些细胞的条件培养基诱导CF增殖。他们共鉴定了12种MI后心脏PW1+细胞过度表达的分泌蛋白。在这些因子中,TGF-β家族成员GDF3在缺血心脏中显著上调。特异性富含GDF3的条件培养基通过刺激激活素受体样激酶在高水平上诱导CF增殖。此外,他们发现GDF3可以在小鼠和人血浆样本中检测到,在MI后的几天内显著增加(图3),较高的GDF3循环水平与MI后6个月不良重塑的风险增加显著相关。这些发现确定了心肌基质细胞通过分泌的心肌因子(如GDF3)的促纤维化作用机制,GDF3是MI后不良纤维化重塑的候选标志物。
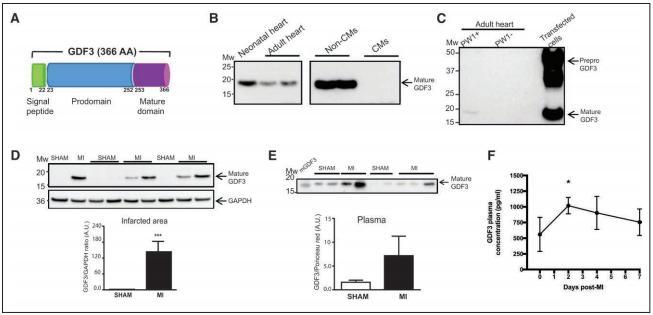
图3.MI后,GDF3在小鼠血浆和MI区表达上调
4. RNA结合蛋白LIN28a通过lncRNA-H19调节心脏新肌细胞的形成
发育中的心脏组织具有显著的损伤后再生能力,由再生的单核和二倍体心肌细胞(MNDCM)组成。成熟后,MNDCM变成双核或多倍体并退出细胞周期。然而,重编程代谢是否促进再生MNDCM的持久性,从而增强心脏功能和损伤后的修复尚不清楚。美国天普大学路易斯卡茨医学院心血管科学系Mohsin Khan团队确定了RNA结合蛋白LIN28a在损伤后心脏修复中的新作用[4]。LIN28a在心脏发育过程中活跃,出生后迅速下降。在成年心脏中,与野生对照组相比,LIN28a的过度表达减弱了MI后小鼠的CM凋亡,增强细胞周期活性、心脏功能和存活率。此外,LIN28a小分子抑制剂减弱了LIN28a对心脏的修复作用。机制上,过表达LIN28a的新生大鼠心室肌细胞显示糖酵解、ATP生成和代谢酶水平增加,确定了lncRNA-H19是LIN28a的靶点(图4)。lncRNA-H19的消融减弱了LIN28a诱导的CM代谢和细胞周期活性的增强。LIN28a在心肌损伤后依赖于RNA与lncRNA-H19的结合,将CM代谢重新编程为糖酵解,从而促进细胞周期活动并增强心脏结构和功能。
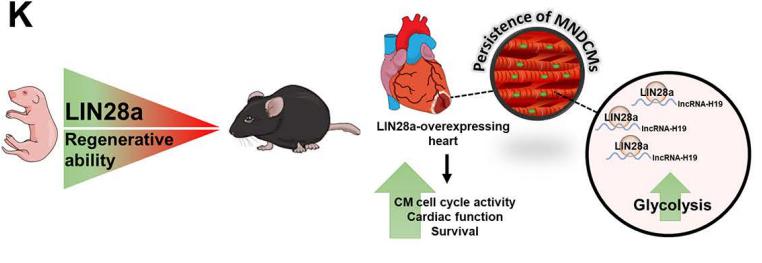
图4.RNA结合蛋白LIN28a通过lncRNA-H19调节心脏新肌细胞的形成
云克隆不仅可提供多种心血管系统疾病模型,包括心肌梗死、心律失常、心肌肥厚、心肌炎、心力衰竭等,涵盖常见心血管系统疾病;还具有各类心血管系统信号通路常用指标及上述mTORC1、GDF3、LIN28a等相关产品,可助力广大科研工作者进行心血管系统疾病研究。
参考文献
[1]Tani H, Sadahiro T, Yamada Y, et al. Direct Reprogramming Improves Cardiac Function and Reverses Fibrosis in Chronic Myocardial Infarction [J]. Circulation. 2022;10.1161/CIRCULATIONAHA.121.058655. (IF=39.918)
[2]Zhang F, Hu G, Chen X, et al. Excessive branched-chain amino acid accumulation restricts mesenchymal stem cell-based therapy efficacy in myocardial infarction [J]. Signal Transduct Target Ther. 2022;7(1):171. (IF=38.104)
[3]Masurkar N, Bouvet M, Logeart D, et al. Novel Cardiokine GDF3 Predicts Adverse Fibrotic Remodeling After Myocardial Infarction [J]. Circulation. 2022;10.1161/CIRCULATIONAHA.121.056272. (IF=39.918)
[4]Rigaud VOC, Hoy R, Kurian J, et al. RNA-binding Protein LIN28a Regulates New Myocyte Formation in the Heart via lncRNA-H19 [J]. Circulation. 2022;10.1161/CIRCULATIONAHA.122.059346. (IF=39.918)

