视网膜相关疾病研究新进展
视网膜是由大脑向外延伸的视觉神经未梢组织。其功能是接受外界的光线刺激,通过光化学作用,将它转换为生理刺激传到中枢产生视觉。任何视网膜疾病,均能引起视功能减退,其受害程度因病变轻重和累及部位而不同。常见的视网膜疾病有糖尿病视网膜病变(DR)、视网膜血管闭塞、视网膜色素变性、年龄相关性黄斑变性(AMD)、青光眼和早产儿视网膜病变等。近期,多篇文献报道了视网膜疾病相关研究,可能为相关疾病的预防和治疗提供帮助。
1. 生物打印3D视网膜外屏障揭示晚期黄斑变性中RPE依赖性脉络膜表型
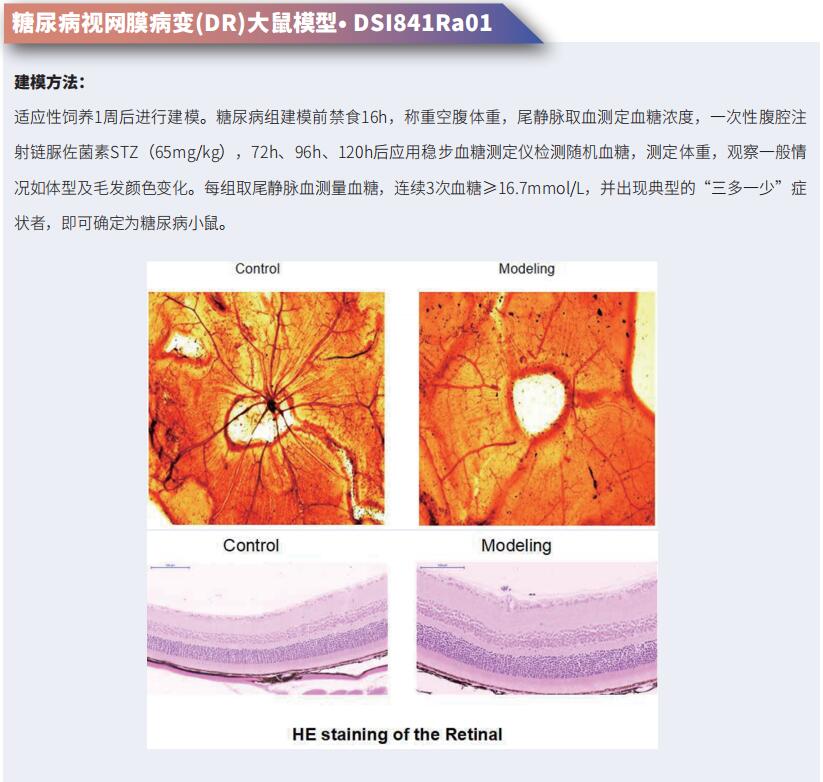
AMD是致盲的主要原因,始于视网膜色素上皮(RPE)、布鲁赫膜和绒毛膜毛细血管形成的外血视网膜屏障(oBRB)。由于缺乏生理相关的oBRB模型,AMD的发病和进展机制仍知之甚少。美国国立卫生研究院国立眼科研究所Kapil Bharti团队通过在可生物降解支架的基底侧生物打印内皮细胞、周细胞和成纤维细胞,并在顶部建立RPE单层,设计了一种天然的类3D oBRB组织[1]。在这种3D oBRB中,具有顶端突起和基底凹陷的全极化RPE单层提供屏障阻力,诱导脉络膜特异性基因在脉络膜中表达,并支持形成布鲁赫样膜,使组织在大鼠眼中整合。3D oBRB中的补体激活触发干性AMD表型(包括RPE下核果和绒毛膜毛细血管变性),缺氧激活的HIF-α诱导湿性AMD表型(绒毛膜毛细血管新生血管)(图1),并通过临床使用的抗VEGF抗体的疗效来验证其临床相关性。这项研究表明构建的3D oBRB将有助于对AMD病理学的更全面的理解,并有助于确定遗传学在疾病表现中的作用。
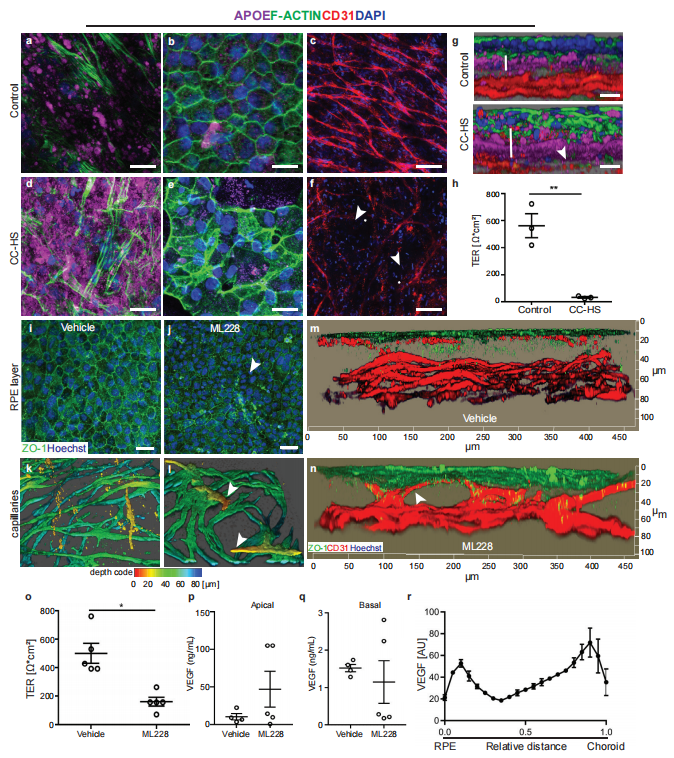
图1.3D-oBRB干湿AMD模型中RPE依赖性脉络膜变性
2. CEP162缺乏导致人类视网膜变性
原发性或活动性纤毛的缺陷会导致各种人类疾病,而视网膜变性通常与这些所谓的纤毛疾病有关。德国森肯伯格人类遗传学中心Hanno J. Bolz团队发现CEP162中截短变体(CEP162-E646R*5)的纯合性导致了2个不相关家族的迟发性视网膜色素变性[2]。CEP162是视网膜纤毛形成和神经元分化过程中过渡区组装所需的中心体和微管相关蛋白。突变体CEP162-E646R*5蛋白在有丝分裂纺锤体中表达并适当定位,但在初级纤毛和光感受器纤毛的基体中缺失。CEP162-E646R*5保持了其结合微管和定位于有丝分裂纺锤体的能力,这表明它可以保留神经元细胞分裂的功能。在发育中的小鼠视网膜中,shRNA敲低CEP162会增加细胞死亡,而CEP162-E646R*5的表达挽救了细胞死亡,这表明突变体保留了其在视网膜神经发生中的作用(图2)。因此,原发性纤毛中CEP162功能的特异性缺失可能是迟发性人视网膜纤毛病的主要原因。
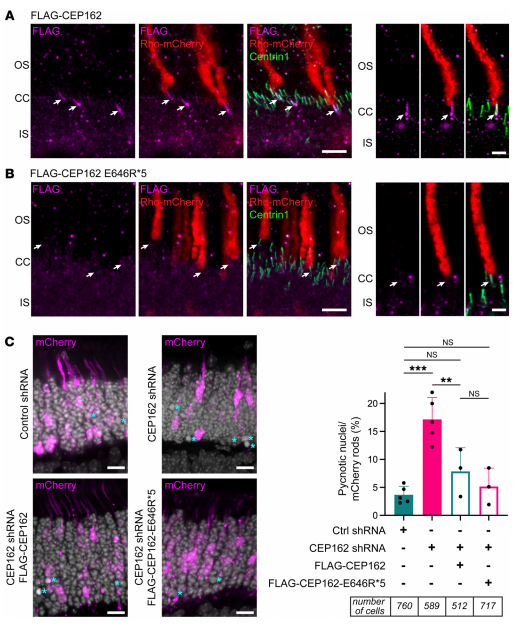
图2.CEP162-E646R*5突变蛋白不定位于成年小鼠视杆光感受器的中心粒,但参与视网膜神经发生
3. 高视网膜渗透性长效白藜芦醇/二甲双胍纳米治疗黄斑变性
有效治疗视网膜疾病的疗法的发展受到各种生物屏障的严重限制。台湾长庚大学生物医学工程系Jui-Yang Lai团队报告了一种纳米医学策略,以开发具有高视网膜通透性和持续生物活性递送的纳米疗法[3]。具体来说,纳米治疗药物是通过白藜芦醇(R)包封的聚己内酯纳米颗粒(R@PCL NP)的氨解,然后与羧基端转录细胞穿透肽(T)和二甲双胍(M)形成酰胺键来合理设计的。R@PCL-T/M NP纳米疗法在体外被证明具有持久的药物释放特性、良好的眼部生物相容性和针对视网膜疾病相关的主要危险因素的有效生物活性。体内研究表明R@PCL-T/M NP可以有效改善视网膜通透性,防止内源性抗氧化剂的损失,并在56天内抑制黄斑变性视网膜中异常血管的生长(图3)。这种高治疗效果可归因于纳米疗法的视网膜通透性增强,以及双重药物(R和M)在视网膜色素上皮区域的持续药理活性。这些发现为开发能够靶向视网膜的药理学纳米制剂,从而以更高的疗效治疗复杂的眼内疾病显示了巨大的前景。
图3.R@PCL-T/M NP对VEGF-A165诱导的鸡绒毛尿囊膜血管生成和血管发育的抑制作用
4. 肽引导的脂质纳米颗粒将信使核糖核酸输送到神经视网膜
基于脂质纳米颗粒(LNP)的mRNA递送有望治疗遗传性视网膜变性。目前,LNP介导的信使核糖核酸递送仅限于RPE和米勒神经胶质。LNP必须克服眼部屏障才能转染对视觉光转导至关重要的神经元细胞,即感光细胞(PR)。美国俄勒冈州立大学罗伯逊生命科学大楼药学院药学系Gaurav Sahay团队使用基于M13噬菌体的组合七聚肽噬菌体展示文库来挖掘靶向PR的肽配体[4]。他们通过体内生物筛选确定了最有希望的候选肽。染料偶联肽显示快速定位到PR。在小鼠模型中,这些肽以不同的表面密度修饰在LNP表面,促使mRNA成功递送到神经视网膜。团队进一步将这些结果转化到更具临床相关性的非人类灵长类动物,在PR、Müller胶质细胞和RPE中观察到强大的蛋白质表达(图4)。总的来说,这项研究已经开发出肽偶联的LNP,它可以将信使核糖核酸递送到神经视网膜,扩大了LNP信使核糖核酸治疗遗传性失明的实用性。

图4.在NHP视网膜下给药后,MH42(候选肽)结合LNP介导神经视网膜中的表达
参考文献
[1]Song MJ, Quinn R, Nguyen E, et al. Bioprinted 3D outer retina barrier uncovers RPE-dependent choroidal phenotype in advanced macular degeneration [J]. Nat Methods. 2023,20(1):149-161. (IF=47.990)
[2]Nuzhat N, Van Schil K, Liakopoulos S, et al. CEP162 deficiency causes human retinal degeneration and reveals a dual role in ciliogenesis and neurogenesis [J]. J Clin Invest. 2023,133(8):e161156. (IF=19.456)
[3]Nguyen DD, Luo LJ, Yang CJ, Lai JY. Highly Retina-Permeating and Long-Acting Resveratrol/Metformin Nanotherapeutics for Enhanced Treatment of Macular Degeneration [J]. ACS Nano. 2023,17(1):168-183. (IF=18.027)
[4]Herrera-Barrera M, Ryals RC, Gautam M, et al. Peptide-guided lipid nanoparticles deliver mRNA to the neural retina of rodents and nonhuman primates [J]. Sci Adv. 2023,9(2):eadd4623. (IF=14.957)
云克隆不仅可提供多种眼内疾病动物模型,涵盖糖尿病视网膜病变、视网膜缺血再灌注损伤、视网膜中央动/静脉阻塞、早产儿视网膜病变、视网膜脱落等常见眼内疾病。还具有各类眼内疾病检测指标以及视网膜星形细胞、视网膜色素上皮细胞、视网膜神经节细胞、眼脉络膜成纤维细胞等原代细胞产品,可助力广大科研工作者进行眼内疾病治疗相关研究。