文献解读 | 一种模拟T细胞的血小板药物偶联物
2023年5月19日,浙江大学药学院浙江省先进释药系统重点实验室顾臻和俞计成团队在《Matter》上发表题为“T cell-mimicking platelet-drug conjugates”的文章,他们开发了一种含有颗粒酶B和穿孔素的人工细胞毒性复合物的血小板药物偶联物,通过模拟T细胞的自然细胞毒性机制来抑制癌症转移。
在这篇文章中,云克隆抗体【血小板反应蛋白(THBS1)多克隆抗体,PAA611Mu01;穿孔素1(PRF1)多克隆抗体,PAB317Mu01;颗粒酶B(GZMB)多克隆抗体,PAA600Mu01】受到科研工作者的认可,荣登优秀国际期刊。


癌症转移是由原发肿瘤脱落的循环肿瘤细胞(CTC)的血行播散引起的。大量CTC与肿瘤转移扩散和不良的临床预后有关。血小板在促进肿瘤转移扩散中起着至关重要的作用。具体而言,CTC可以被血小板募集,并通过P-选择素和CD44受体介导的生物分子结合形成血小板CTC聚集体。CTC周围血小板的聚集阻止了肿瘤细胞被自然杀伤(NK)细胞清除,并赋予了对血流机械剪切应力的抵抗力。因此,可以利用血小板与CTC的生理相互作用来开发抑制肿瘤转移扩散的药理学工具。
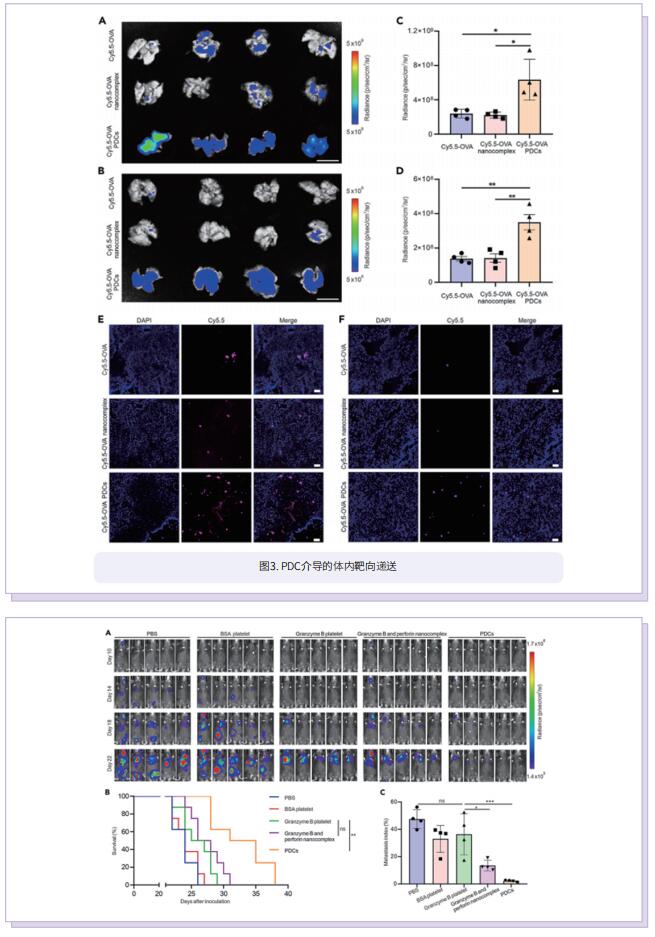
在这项研究中,作者开发了含有颗粒酶B和穿孔素的人工细胞毒性复合物的血小板药物偶联物(PDC),以T细胞非依赖性方式消除CTC。由于血小板对CTC的特异性识别,PDC优先与CTC结合,在血液中形成血小板CTC聚集体。此外,被募集到肿瘤新血管系统和发炎的肿瘤微环境中的血小板将与周围的肿瘤细胞结合。一旦PDC被激活,细胞内P-选择素被转运到细胞表面,通过与CD44的相互作用增强血小板与癌症细胞的粘附。随后,活化的PDC释放血小板微粒(PMP)和细胞毒性蛋白,通过微粒上的粘附蛋白如P-选择素和血小板反应蛋白(TSP-1)攻击CTC,这模拟了细胞毒性T淋巴细胞(CTL)分泌的超分子攻击颗粒(SMAP)的形成。最后,他们证明了在B16F10和4T1肿瘤模型中,负载细胞毒性蛋白复合体的PDC有效地消除了CTC并抑制了肿瘤转移。
综上所述,作者将血小板转化为CTC靶向的“特洛伊木马”杀手,并为其配备了一系列细胞毒性蛋白复合物,用于模拟T细胞的肿瘤杀伤。这种策略也为开发治疗癌症和其他疾病的靶向细胞疗法提供帮助。