文献解读 | Src-ZNRF1轴控制TLR3转运和干扰素反应,以限制肺屏障损伤

2023年5月9日,国立台湾大学医学院分子医学研究所Li-Chung Hsu团队在《Journal of Experimental Medicine》上发表题为“The Src-ZNRF1 axis controls TLR3 trafficking and interferon responses to limit lung barrier damage”的文章,表明c-Src–ZNRF1轴是控制TLR3运输和终止TLR3信号传导的负反馈机制。

在这篇文章中,云克隆试剂盒【干扰素β(IFNb)检测试剂盒(酶联免疫吸附试验法),SEA222Mu】受到科研工作者的认可,荣登优秀国际期刊。

I型干扰素(IFN)在抗病毒免疫中起着至关重要的作用,但其反应的失调会导致炎症和自身免疫性疾病的发生和发展。TLR3是内体TLR家族的一员,在免疫细胞和许多非免疫细胞中大量表达。在与其配体结合后,TLR3经历二聚体化和构象变化,然后募集TRIF并启动一系列信号级联,以促进I型IFN和促炎细胞因子的产生。然而,终止TLR3信号传导的机制仍然不清楚。
在这项研究中,作者发现E3泛素连接酶ZNRF1通过控制TLR3的内吞运输和降解来负调节内体TLR3驱动的免疫反应。在TLR3激活时,c-Src通过其第103个酪氨酸残基的磷酸化激活ZNRF1,激活的ZNRF1与TLR3结合,并在TLR3 K813处介导K63连接的多泛素化,以通过溶酶体途径促进受体降解。缺乏ZNRF1的小鼠和细胞对脑心肌炎病毒和严重急性呼吸系统综合征冠状病毒2型的感染具有抗性,因为TLR3信号持续时间延长和I型IFN产生增加。然而,TLR3持续激活延长I型IFN反应加剧了ZNRF1缺陷小鼠由抗病毒免疫引发的肺屏障损伤,导致对呼吸道细菌重叠感染的易感性增强。
综上所述,这项研究揭示了ZNRF1在控制TLR3信号终止以防止过量I型IFN产生和肺组织修复损伤方面的新生理功能。
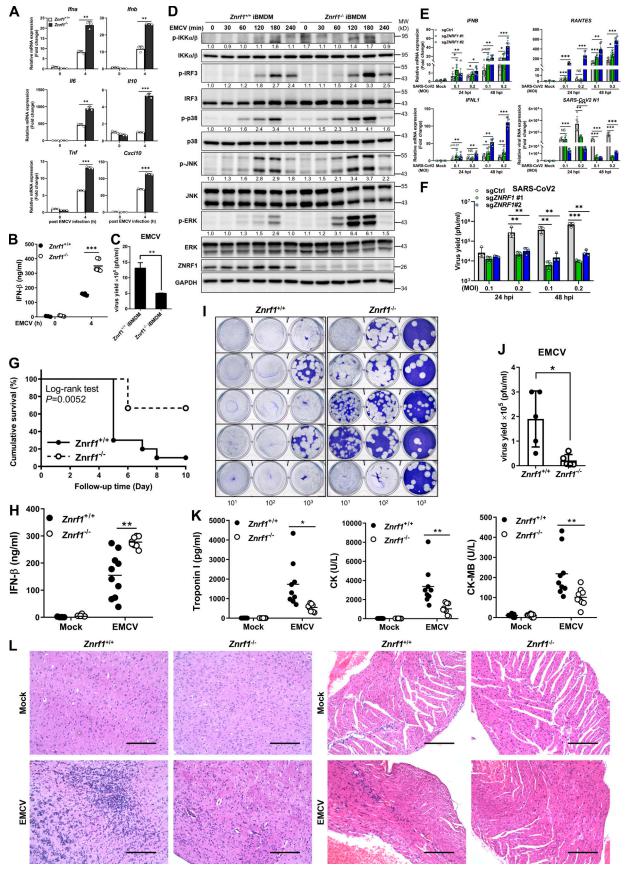
图1 ZNRF1缺陷细胞和小鼠对EMCV和严重急性呼吸系统综合征冠状病毒2型感染具有耐药性
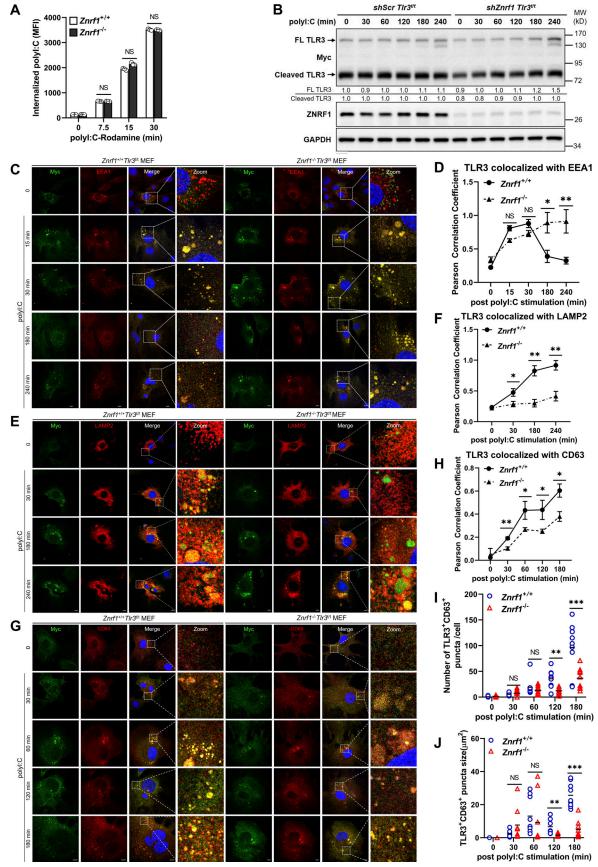
图2 ZNRF1促进TLR3从内体向溶酶体的运输

图3 ZNRF1介导K813处TLR3 K63连接的多泛素化抑制I型IFN的产生和EMCV的繁殖
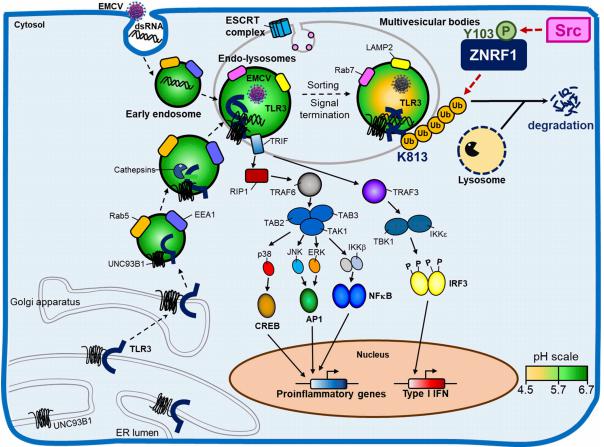
图4 ZNRF1对TLR3运输和I型IFN产生调控的示意图


