NLRP12-溶血性和炎症性疾病的潜在药物靶点
含NLR家族pyrin结构域蛋白12(NLRP12)是较晚发现的一种NLRs家族蛋白,由位于19号染色体上的NLRP12基因编码生成,分布于髓系细胞中,以中性粒细胞和嗜酸性粒细胞居多,同时也存在于脑、肺、脾等多种器官中。有相关研究表明NLRP12与核因子κB(NF-κB)等多种信号通路有关,抑制炎症因子产生,进而负向调控炎症反应。因此,NLRP12功能异常与多种炎症疾病的发生相关。
近期,美国圣犹达儿童研究医院的一项研究发现NLRP12是血红素和病原体相关分子模式(PAMPs)介导的PANoptosis(泛凋亡)、炎症和病理的必需细胞溶质感受器,表明NLRP12和该通路中的分子是溶血性和炎症性疾病的潜在药物靶点。相关研究结果于2023年6月1日发表在《Cell》期刊上,论文标题为“NLRP12-PANoptosome activates PANoptosis and pathology in response to heme and PAMPs”。

血红素在低血清条件下可激活NLRP3炎症小体诱导细胞死亡,但在更多生理条件下涉及的细胞质感受器和分子机制仍不清楚。实验人员向骨髓来源的巨噬细胞(BMDMs)分别加入血红素、Pam3(一种TLR2配体,是炎症通路的强效激活剂)、LPS+ATP(诱导经典NLRP3炎症小体)以及血红素+Pam3来诱导细胞死亡,并且观察BMDMs的生化特征。与单独使用血红素或Pam3相比,使用LPS + ATP后炎症小体被活化并且切割GSDMD(gasdermin D),使其形成P30片段与细胞膜结合,形成焦亡小孔,进而引发细胞炎性死亡。与使用LPS+ATP相比,血红素+Pam3处理后,未观察到GSDMD的P30片段。但是可以看到凋亡的半胱天冬酶(caspase-8、caspase-3 和 caspase-7)更容易被活化,而caspase-3和caspase -7的激活可以切割GSDMD产生P20片段来使其失活。此外,还观察到混合谱系激酶结构域样假激酶(MLKL) 被磷酸化(pMLKL)以及GSDME(gasdermin E)因被裂解而激活,而活化的GSDME可在特定条件下诱导细胞死亡。这些数据表明,来自血红素+PAMPs处理的协同信号诱导了多种细胞死亡标志物。这些标志物证明细胞出现PANoptosis(泛凋亡),而不是单一的激活细胞焦亡、细胞凋亡或坏死性凋亡。
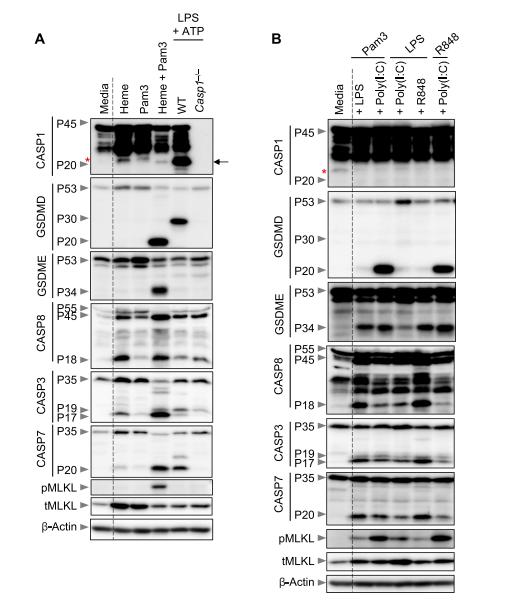
图1 血红素+PAMPs诱导炎性细胞死亡
图片源自《Cell》杂志
因为血红素+PAMPs组合可以诱导细胞死亡,为了明确在释放血红素的溶血性疾病中哪些NLRPs有差异表达,研究人员分析了疟疾或镰状细胞病(SCD)患者的公开数据集。结果显示NLRP3、NLRP12在这些样本中被高度上调,NLRP6仅在疟疾患者的CD71+骨髓细胞中显著上调,而NLRP2和NLRP1没有上调。为了确定这些上调的NLRPs是否在血红素参与的炎症细胞死亡中发挥作用,研究人员评估了用血红素+Pam3刺激的NLRP12、NLRP3和NLRP6缺陷型BMDMs中的细胞死亡情况。在加血红素+Pam3的野生型(WT)和Nlrp6−/−BMDMs中发生了相似水平的细胞死亡。Nlrp3−/−BMDMs中细胞死亡水平降低,而Nlrp12−/−BMDMs中细胞死亡最少。这些数据表明,在小鼠和人类细胞中,NLRP12是血红素+PAMPs驱动炎症细胞死亡所必需的。接下来,研究人员确定了NLRP12的缺失如何在分子水平上影响细胞死亡。在使用血红素+Pam3处理的情况下,与野生型BMDMs相比,Nlrp12- /- BMDMs中caspase-1、GSDMD(尤其是P20形式)、GSDME、caspase-8、caspase-3和caspase-7的切割减少,MLKL的磷酸化减少,这表明NLRP12调节炎症小体和炎症细胞死亡分子的激活,以控制血红素+PAMPs诱导的细胞死亡。
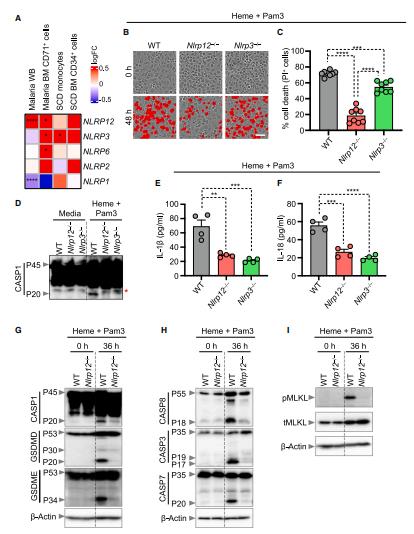
图2 NLRP12调节由血红素+PAMPs诱导的炎症细胞死亡
图片源自《Cell》杂志
除了炎症小体之外,研究人员还观察到caspase-8在NLRP12介导血红素+PAMPs的炎症细胞死亡中发挥重要作用。用血红素+Pam3处理WT、Nlrp12-/-和Pycard-/-BMDMs后的免疫沉淀显示在WT BMDMs中形成了含有ASC(凋亡相关斑点样蛋白)、RIPK3(受体相互作用的丝氨酸/苏氨酸蛋白激酶3)、caspase-8和NLRP3的多蛋白PANoptosome复合物。而在没有NLRP12的情况下,这种复合物的形成受到阻碍。由此可以看出炎症小体是这种多蛋白PANoptosome复合物的组成部分,通过血红素+PAMPs的刺激驱动炎症细胞死亡。为了进一步证实NLRP12是PANoptosome的一部分,研究人员在293T细胞中过表达人NLRP12、NLRP3、ASC、caspase-8和RIPK3,并使用ASC和NLRP12蛋白作为诱饵进行免疫沉淀。再次鉴定出了包含ASC、NLRP12、NLRP3、caspase-8和RIPK3的多蛋白复合物,并且在没有NLRP3的情况下仍然形成复合物。由此可见,在血红素+PAMPs的刺激下,NLRP12形成了一个包含炎症小体和caspase-8以及其他细胞死亡分子的PANoptosome来执行细胞死亡。
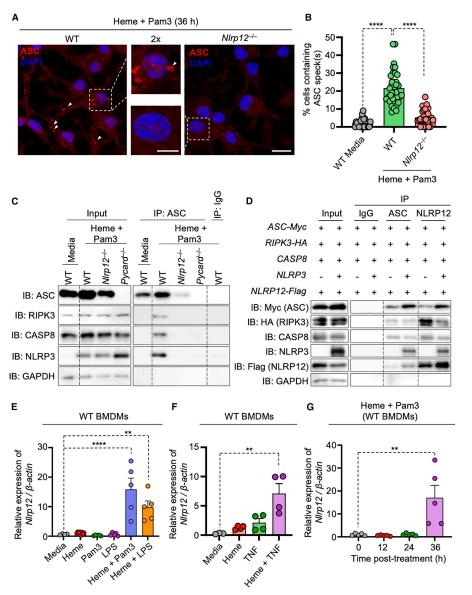
图3 NLRP12与细胞死亡分子形成PANoptosome来执行细胞死亡
图片源自《Cell》杂志
为了进一步了解NLRP12表达的调控及其与疾病病理学的关系,研究人员测量了BMDMs中NLRP12的表达水平。血红素+PAMPs和血红素+TNF-α处理后NLRP12的表达显著上调。此外,NLRP12的表达在处理后12或24小时时间点没有变化,但是在36小时时间点增加。与NLRP12表达的时间一致,细胞死亡开始于处理后30-32小时,表明NLRP12的表达与细胞死亡相关。此外,NLRP12的表达仅在用血红素+PAMPs或血红素+TNF-α联合处理的BMDMs中增加,在单独用血红素、Pam3、LPS或TNF-α处理的BMDMs中没有增加,表明血红素+PAMPs或血红素+TNF-α共同介导NLRP12表达所需的信号传导。通过分析来自溶血性疾病患者的公开单细胞转录组学数据集,发现与来自健康对照骨髓的细胞相比,在β地中海贫血或SCD患者的髓系和造血干细胞以及在β地中海贫血患者的红系细胞中,NLRP12表达增加。这些结果表明NLRP12在多种细胞类型中的表达与溶血性疾病有关。
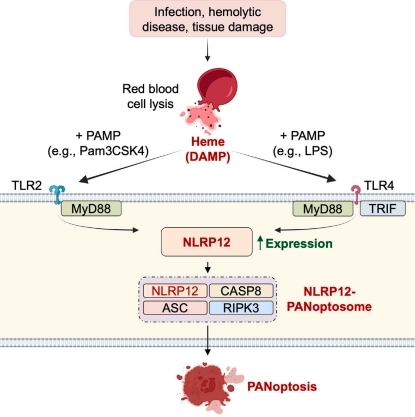
图4 NLRP12参与溶血性疾病细胞的PANoptosis
图片源自《Cell》杂志
研究结果表明NLRP12负责血红素+PAMPs介导的炎症小体和PANoptosome的激活,以驱动炎症细胞死亡。因此,靶向NLRP12或其他PANoptosome成分以及炎症细胞死亡分子可能在各种感染和炎症性疾病中具有较大的治疗潜力。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力相关疾病的研究,部分指标节选如下,供参考:
靶标核心 货号
NF-kB B824
NLRP3 K115
GSDMD E529
Caspase 8 A853
Caspase 7 A449
MLKL R645
RIPK3 E639
IL18 A064
IL1b A563