细胞死亡与癌症(四)——NETosis与癌症的关联
NETosis是一种由中性粒细胞胞外捕获网(Neutrophil extracellular traps,NETs)驱动的程序性细胞死亡方式,是中性粒细胞死亡的一种独特形式。简单来说,NETs形成的过程被称为NETosis。NETs是由活化的中性粒细胞释放出的DNA和内容物形成的网状结构,是其捕获和杀死细菌以及真菌的重要方式。而近年来的诸多研究表明NETs可促进肿瘤的发展、转移和化疗耐药性。而基于这些研究,靶向NETs可作为一种治疗肿瘤极具前景的新方案。
NETs促进肿瘤的发展
肿瘤细胞释放细胞因子和趋化因子,如IL-8、G-CSF、CXCL5和CXCL6,从血液中招募中性粒细胞到肿瘤微环境(Tumor microenvironment,TME)。进入TME的中性粒细胞受到刺激后,诱导产生NETs和NETosis(见图1)。NETs在癌细胞周围形成网络,通过物理屏障作用保护肿瘤细胞免受细胞毒性T淋巴细胞和NK细胞的攻击。
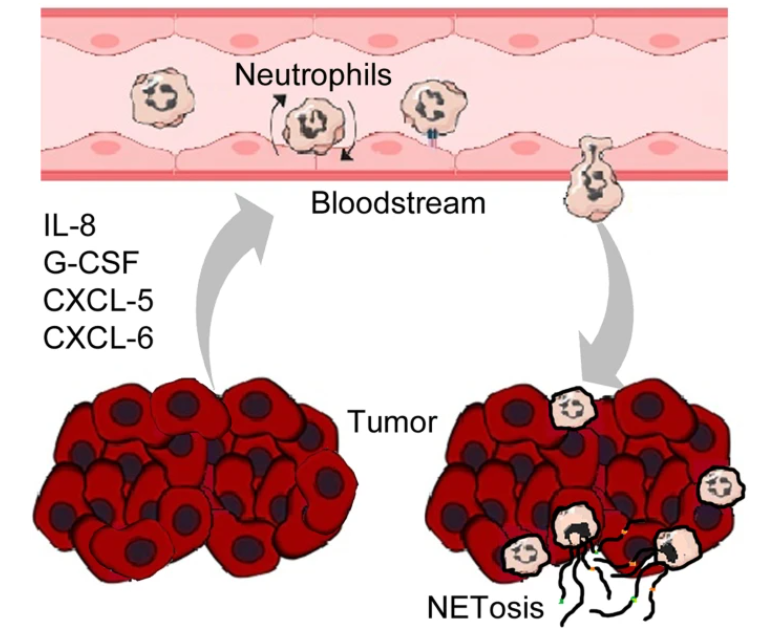
图1. 肿瘤细胞招募中性粒细胞和诱导产生NETosis
(图片源自《Journal of Experimental & Clinical Cancer Research》杂志)
中性粒细胞蛋白也是NETs的重要成分,所以NETs成分因子与肿瘤进展之间的关联多是以中性粒细胞蛋白的研究为基础的。NETs局部微环境是由原生细胞蛋白(NE、MPO)及次生细胞蛋白(MMP9、pentraxin 3)等包裹修饰形成。研究表明NETs水平升高(通过检测血清MPO-DNA复合物来评估)与结直肠癌患者的转移表型相关。此外,在乳腺癌和胃癌中,血液循环中NE-DNA复合物的水平随着癌症的分期而增加。除MPO、NE外,MMP9也有助于癌症发生,进展和转移。这种作用已在几种癌症模型中得到证实,包括胰腺癌模型、Lewis肺癌细胞自发肺转移模型和hpv16导致的皮肤癌模型。MMP9还可以促进细胞外基质释放VEGF,从而促进肿瘤的血管生成,增加肿瘤细胞的营养供给,增强肿瘤细胞与宿主细胞间的黏附作用而促进肿瘤细胞转移。
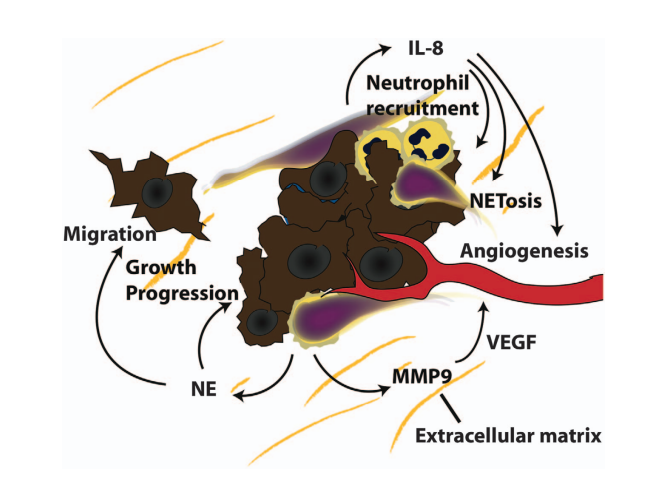
图2. NETs以多种方式影响癌症的生长和进展
(图片源自《Oncogene》杂志)
NETs导致肿瘤化疗耐药
近期发表在《Cancer Cell 》的研究发现,肿瘤转移化疗过程中TME诱导中性粒细胞募集并形成NETs,可显著减弱化疗药物的治疗反应。研究团队测定了乳腺癌化疗患者的血浆样本中的NETs水平,产生化疗耐药的患者血中NETs水平显著升高,部分有化疗疗效的患者血中NETs水平普遍不高。为了进一步证实NETs与肿瘤化疗耐药的直接关联,研究团队用含NETs的培养基与乳腺癌细胞共培养,使乳腺癌细胞化疗耐药。随后使用PAD4抑制剂或DNase I清除NETs,可观察到明显的化疗疗效。研究进而揭示了化疗会促进NETs形成以及NETs导致化疗耐药的作用机理。化疗导致肿瘤细胞死亡,死亡的肿瘤细胞可分泌大量的IL-1β,IL-1β触发NETs的形成。而TGF-β是NETs导致化疗耐药关键因子。两种NETs成分因子integrin-αvβ1和MMP9在化疗耐药中起到重要作用。integrin-αvβ1捕获latent TGF-β,MMP9切割latent TGF-β并释放active TGF-β。NETs在癌细胞中诱导TGF-β依赖的上皮—间充质细胞的转化(Epithelial-Mesenchymal Transition,EMT),从而引发化学耐药。
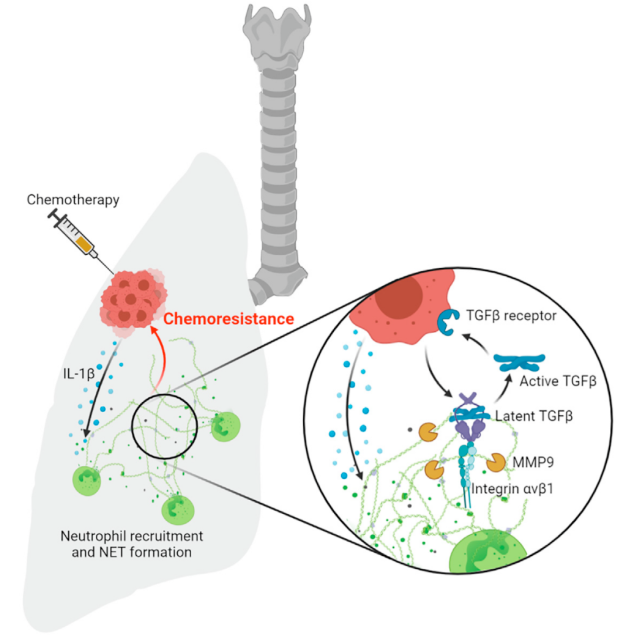
图3. NETs通过激活TGF-β导致化疗耐药性
(图片源自《Cancer Cell》杂志)
靶向NETs的肿瘤治疗方案
基于NETs和NETosis的促癌作用,靶向NETs成分因子被科研研究者们视为一种有前景的癌症治疗方法。NETs成分因子(如CXCR1/2、PAD4、NE等)小分子抑制物和DNase I(一种FDA批准的治疗囊性纤维化的药物,可消化NETs)已被用于临床前模型。PAD4是一种介导中性粒细胞形成NETs的酶,其药理抑制作用已被用于小鼠乳腺癌转移模型、小鼠β细胞癌变模型等几种癌症动物模型。且在小鼠实验中,使用PAD4小分子抑制物可以预防与乳腺癌和胰腺癌相关的肾功能障碍。而在乳腺癌肺转移的小鼠模型中,DNase I或PAD4抑制剂等抗NETs疗法能干扰肿瘤转移。在临床前模型中,通过敲除PAD4基因、药理学抑制NE或DNase I治疗的NETs靶向治疗可降低肺癌和结肠癌的侵袭。
云克隆关联产品