通过巨噬细胞与癌细胞的生存竞争来抑制肿瘤生长
在后生生物中,细胞竞争作为一种质量控制机制,淘汰不适应的细胞,从而有利于其更健壮的邻居。人类癌症中经常观察到原癌基因(MYC)过表达和Yes相关蛋白(YAP)核聚集现象, 这提示癌细胞可能通过这两种蛋白的活性升高而转化成“优势”竞争者。然而,仅MYC过表达通常不足以引起细胞转化,还可能引发细胞凋亡。而致癌途径如何促进MYC过表达癌细胞的超级竞争状态,以及宿主因子是否调节MYC介导的癌细胞竞争尚不清楚。2023年6月,《Nature》杂志上发表了一篇题为“Reprogramming tumour-associated macrophages to outcompete cancer cells”的文章,在这项研究中,研究者发现肿瘤相关巨噬细胞(TAMs)可以通过饮食或基因重编程来战胜MYC过表达的癌细胞。在TAMs中,非典型吞噬介导的小G蛋白Rag GTPase不依赖mTORC1(雷帕霉素靶点复合体1)信号传导控制TAMs和癌细胞之间的竞争,这定义了一种新的先天性免疫肿瘤抑制途径,可以靶向癌症治疗。

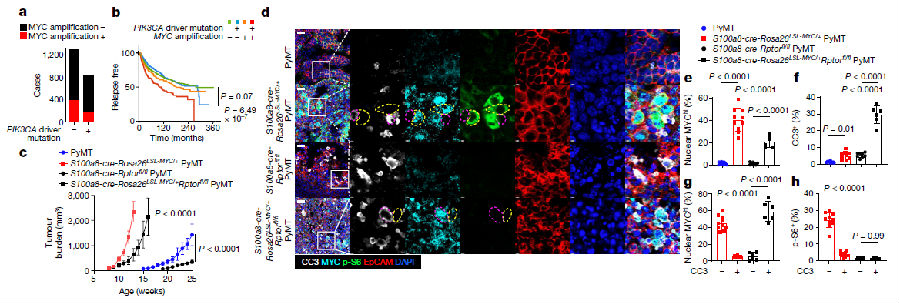
MYC扩增以及编码磷脂酰肌醇激酶(PI3K)的p110a亚基的磷酸肌醇-3-激酶催化α多肽(PIK3CA)基因的功能获得性突变发生在人类乳腺癌的分子亚型中,这类乳腺癌患者特点是无复发,生存期最短。为了研究MYC和PI3K在肿瘤发展中的交叉调节,研究者选用由多瘤病毒中间肿瘤抗原(PyMT)驱动的乳腺癌转基因小鼠为模型,该抗原可以激活PI3K。研究人员发现与对照-PyMT小鼠(对照组)相比,MYC-PyMT小鼠(MYC组)肿瘤发病更早,肿瘤生长更快,这些现象与MYChi癌细胞数量增加以及凋亡癌细胞相关。凋亡的癌细胞MYClo定位在MYChi癌细胞附近,这表明MYC介导了癌细胞竞争。免疫荧光结果显示MYC组的MYChi获胜癌细胞代谢活跃,细胞大小较大,这与mTORC1过度激活有关。这些发现表明mTORC1信号传导在促进MYC组中MYChi癌细胞的竞争适应性方面发挥了重要作用。在肿瘤侵袭过程中,保存mTORC1活化的MYChi获胜癌细胞存在强大的选择压力。(见图1)
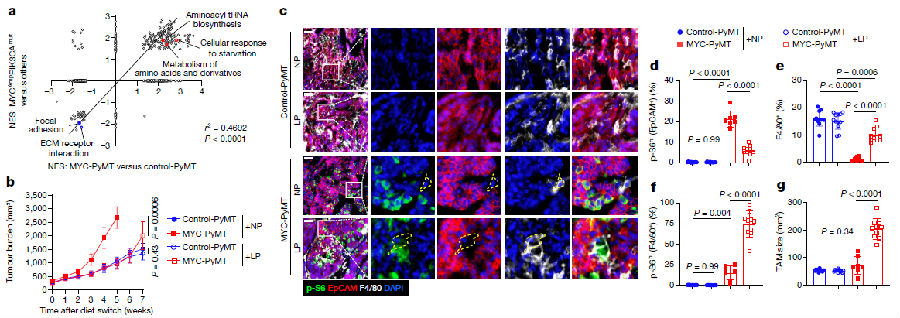
研究人员对对照组和MYC组肿瘤样本进行RNA测序,发现与细胞饥饿反应相关的转录本被富集,意味着MYC组癌细胞处于持续的压力下,需要获取氨基酸等营养物质来支持蛋白质合成。接下来,研究者用含有2%蛋白质的等热量低蛋白(LP)饮食和含有15%蛋白质的正常蛋白(NP)饮食分别处理MYC组和对照组小鼠。与正常蛋白(NP)饮食相比,低蛋白(LP)饮食抑制了MYC组的肿瘤生长,研究者发现这与癌细胞中mTORC1信号的减弱有关。与免疫荧光分析一致,流式细胞术显示,与对照组小鼠相比,NP饮食条件下MYC组的肿瘤薄壁定位TAMs数量减少,在LP饮食条件下TAMs重新繁殖,而肿瘤基质定位乳腺组织巨噬细胞(MTMs)或单核细胞数量不受影响。在LP饮食处理的MYC组中,重新繁殖的TAMs细胞大小更大。说明NP和LP饮食在癌细胞中具有与MYC组TAMs相反的mTORC1调节功能,mTORC1的过度激活与TAM的生长和扩展有关。(见图2)
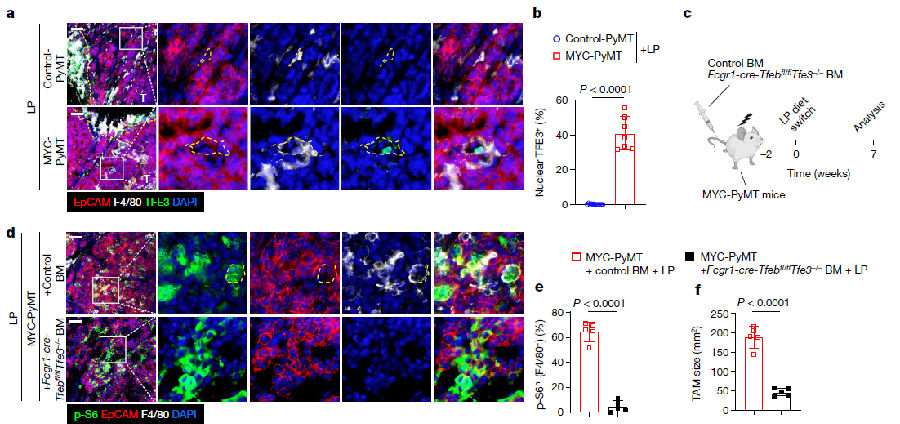
免疫荧光结果显示,在LP饮食处理的MYC组肿瘤的TAMs中检测到核TFE3。为了确定TFEB和TFE3在TAMs中的功能,研究者使用来自Fcgr1-cre-Tfeb fl/flTfe3-/-和对照小鼠的骨髓细胞去重建致命辐射的MYC小鼠,然后用LP饮食处理。研究人员发现TFEB和TFE3的缺失抑制了TAMs中的mTORC1信号传导,MYC组肿瘤中TAMs的生长和扩增也被抑制。癌细胞中的mTORC1信号被增强,低脂饮食诱导的肿瘤抑制作用失效。Raptor缺失抑制了TAM中的p-S6信号和TAMs的生长和扩张,而MYC癌细胞中的mTORC1信号恢复,肿瘤生长恢复。这些发现表明,在低脂饮食条件下,MYC癌细胞中mTORC1信号的丢失和获胜细胞状态不是细胞自主的,而是通过TFEB-TFE3依赖机制依赖于TAMs中mTORC1信号的获得。(见图3)

免疫荧光结果显示,在LP饮食处理的MYC组肿瘤的TAMs中检测到核TFE3。为了确定TFEB和TFE3在TAMs中的功能,研究者使用来自Fcgr1-cre-Tfeb fl/flTfe3-/-和对照小鼠的骨髓细胞去重建致命辐射的MYC小鼠,然后用LP饮食处理。研究人员发现TFEB和TFE3的缺失抑制了TAMs中的mTORC1信号传导,MYC组肿瘤中TAMs的生长和扩增也被抑制。癌细胞中的mTORC1信号被增强,低脂饮食诱导的肿瘤抑制作用失效。Raptor缺失抑制了TAM中的p-S6信号和TAMs的生长和扩张,而MYC癌细胞中的mTORC1信号恢复,肿瘤生长恢复。这些发现表明,在低脂饮食条件下,MYC癌细胞中mTORC1信号的丢失和获胜细胞状态不是细胞自主的,而是通过TFEB-TFE3依赖机制依赖于TAMs中mTORC1信号的获得。(见图4)

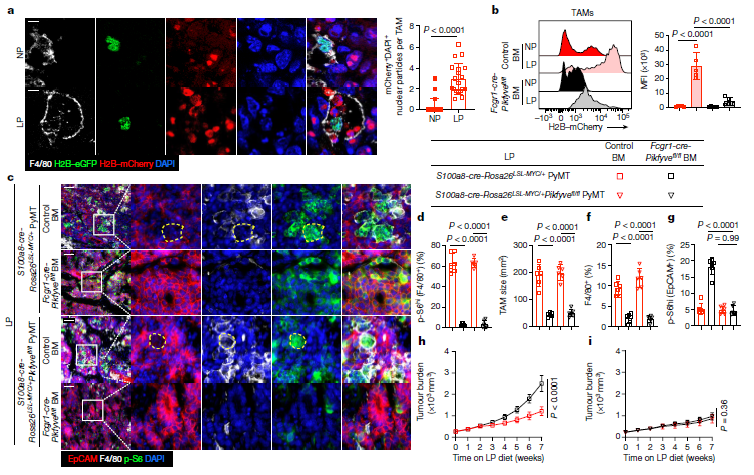
研究者通过免疫荧光观察到在LP饮食处理的MYC肿瘤的TAMs中平均检测到三个癌细胞核颗粒,而在NP饮食处理的MYC小鼠中很少观察到TAM吞噬事件。然后构建了Fcgr1-cre-Pikfyvefl/fl小鼠来诱导巨噬细胞特异性消耗PIKfyve。PIKfyve的消耗减少了LP饮食诱导的H2B-mCherry标记的核颗粒从癌细胞中摄取TAM。研究者对PIKfyve缺陷TAM重建的小鼠,用LP饮食处理后进行免疫荧光检测,发现PIKfyve缺陷的癌细胞不激活由TAMs中PIKfyve缺失引发的mTORC1,肿瘤生长不增强。TAMs中PIKfyve的缺失损害了它们对凋亡细胞和凋亡小体的吞噬,并且在癌细胞中检测到凋亡小体的摄取增强。这表明TAM对MYC肿瘤生长的抑制是由它们的清除功能介导的,并且这些TAMs与癌细胞竞争吞噬介导的营养获取和mTORC1激活,是由TAMs和癌细胞的共同适应程度决定的。
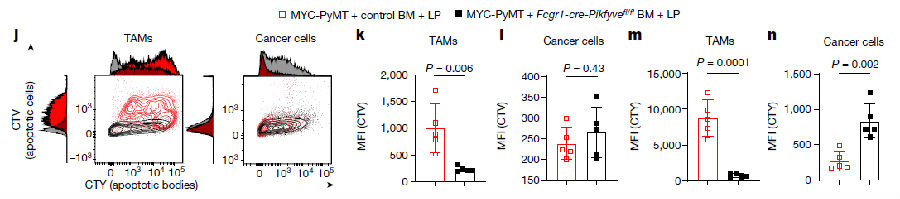
总的来说,这些发现说明癌细胞行为的改变可以从根本上改变TAM从癌细胞同谋到癌细胞竞争对手的分化轨迹和功能状态。利用这种独特的先天免疫肿瘤抑制途径,有望为癌细胞竞争引发的侵袭性恶性肿瘤提供新的免疫治疗。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力肿瘤治疗相关研究,部分指标节选如下,供参考:
指标名 | 核心货号 | 指标名 | 核心货号 |
MYC | B290 | TFE3 | J718 |
CD45 | B030 | VCAM1 | A547 |
CD11b | B685 | CD11c | B159 |
FLCN | J102 | PIK3CA | J830 |
Raptor | M681 | PIKFYVE | L531 |
EpCAM | B283 | CASP3 | B626 |