Nature子刊:短期“盛宴饮食”可导致粘膜和全身免疫功能下降
杂食性动物(包括小鼠和人类)更喜欢富含脂肪的饮食,而不是植物性饮食,特别是在短期内,但这种短期摄入富含脂肪饮食的后果尚不清楚。2023年8月14日,德国汉堡大学埃彭多夫医学中心的研究团队在《Nature Immunology》期刊发表了题为“Short-term dietary changes can result in mucosal and systemic immune depression”的文章。该研究表明:短期反复切换到“盛宴饮食”(模仿我们的社会饮食行为),破坏了肠道微生物群的潜在缓冲作用,重组了粘膜相关淋巴组织的免疫结构。第一次饮食转换就足以诱导短暂的粘膜和全身免疫抑制,导致对肠沙门氏菌、血清型鼠伤寒沙门氏菌和单核增生李斯特菌感染的易感性增加。具体机制是:由于纤维代谢物的微生物供应减少,mTOR(mammalian target of rapamycin)活性受损,导致CD4+ T细胞代谢适应度和细胞因子减少。重新引入膳食纤维可以重新进行T细胞代谢,恢复粘膜和全身CD4+ T细胞功能和免疫力。

首先,研究者每隔3天将小鼠的饮食在常规食物(RD)和富含动物源性脂肪但缺乏纤维的饮食(FD)之间交替,共进行了四次转换。观察到体重、血清胆固醇水平、能量消耗和核心温度在每次饮食转换时都以振荡方式变化。与其他研究一样,在FD喂养的小鼠中观察到大量的乳酸乳球菌。III型细胞因子Il17a、Il17f和Il22在第一次切换到FD后显著下调(在与肠道微生物群相互作用的反应中,CD4+ T细胞可以通过产生III型细胞因子持续促进粘膜稳态,最终使宿主对即将到来的感染不那么敏感)。然后,研究者用肠炎沙门氏菌血清型鼠伤寒沙门氏菌感染小鼠,它主要通过PPs(潘氏斑,或称派尔斑,Peyer's patches)中的微折叠细胞侵入肠道组织,然后传播到全身部位。结果显示,切换到FD的小鼠体重明显减轻,并且菌落形成单位在小肠(small intestine,SI)腔内含量、小肠组织和肝脏中的数量高于对照组小鼠。与此一致的是,切换到FD的感染小鼠PPs中,与体液和细胞免疫应答相关的通路下调。这种饮食变化也会影响全身免疫反应,小鼠切换到FD后,不能有效地清除由单核细胞增生李斯特菌引起的全身感染。此外,在经典的迟发型超敏反应(DTH)模型中,用OVA诱导后,切换到FD的小鼠不能有效地诱导足垫肿胀。由此表明短期FD饮食会损害小鼠粘膜和全身免疫。(见图1)
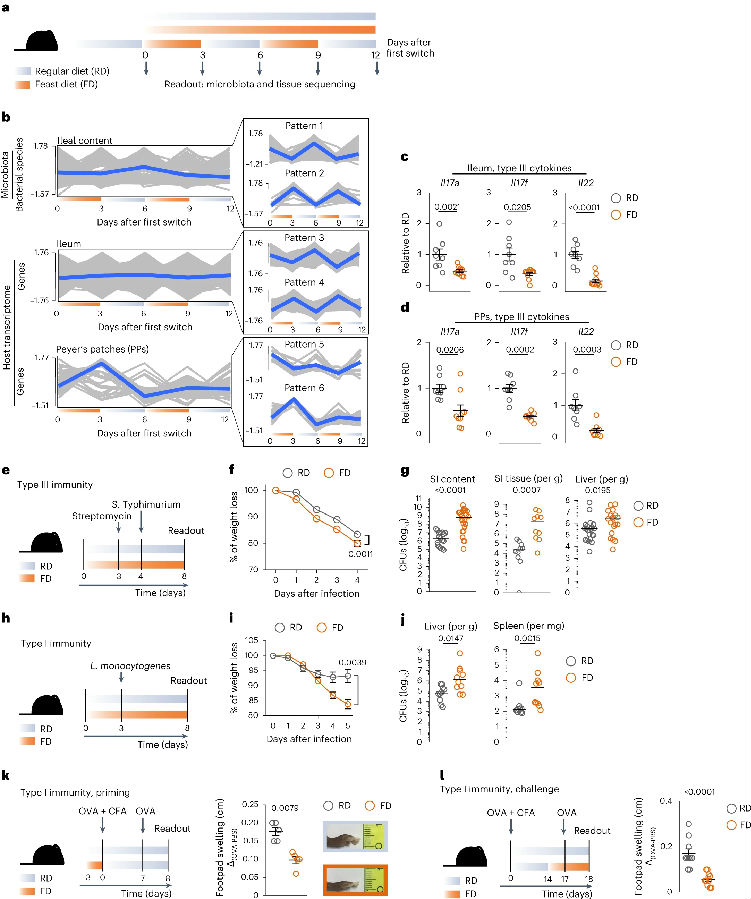
图1. 短期FD饮食会损害小鼠粘膜和全身免疫
(文中所有图片均来源于《Nature Immunology》杂志)
基于以上结果,研究者假设粘膜免疫的损害可能是通过减少效应/记忆性CD4+ T细胞和III型细胞因子导致的。因此,他们将重点放在CD4+效应T细胞上,并通过流式细胞术评估CD4+Foxp3−T细胞转录组,这些细胞是从切换到FD的小鼠PPs中分离出来的。结果显示介导III型粘膜免疫的Il17re、Il22和Gzmb显著下调。呈现TH17极化状态及表达IL10的TH17细胞数量显著减少。在exTH17细胞(即过去表达IL17A,但目前不表达的细胞)中也观察到类似的趋势。粘膜CD4+ T细胞是IL17A的主要产生细胞,而IL17F也会同时产生。这些结果表明,饮食的短期改变会抑制肠道CD4+ T细胞及粘膜III型细胞因子Il17a、Il17f和Il22的表达。与此一致的是,已知由IL17A、IL17F和IL22诱导的抗菌肽Reg3b和Reg3g在切换到FD后沿SI显著下调。接下来,研究者想验证FD喂养小鼠对鼠伤寒沙门氏菌的高易感性是否是由于FD驱动IL17A/IL17F的下调。因此,研究者构建了IL17A/IL17F双敲除小鼠,对照组和模型组保持RD或切换FD,均感染鼠伤寒沙门氏菌。结果显示RD喂养的双敲除小鼠控制细菌感染能力的受损程度与FD喂养的小鼠相同。此外,给双敲除小鼠喂食FD没有进一步增加细菌负荷。这些发现表明,在感染前,FD介导的IL17A和IL17F的减少,使肠道在切换到FD后更容易感染鼠伤寒沙门氏菌。(见图2)

图2. 短期FD饮食会影响粘膜CD4+ T细胞
研究者们希望能找到系统免疫损伤背后的细胞机制,决定将重点放在DTH-OVA模型上,这可以直接研究抗原特异性CD4+ T细胞。结果发现:转换为FD后,OVA特异性CD4+ T细胞中,与免疫应答相关的通路显著下调。已知负调控T细胞活化的基因(Zbtb32、 Nt5e、 Anp32a和Hdac7)以及细胞因子产生的负调控基因(Spry1、 Maf、Tsc22d3和Jazf1)上调。相反,T细胞活化的关键基因(Tnfsf4、Lat、Trat1和Klrd1)、细胞因子产生的正调节因子(Bcl6、Ltb和Ly9)和I型干扰素基因(Irf7、Rtp4、Isg15和Gbp5)下调。在FD期间,OVA特异性CD4+ T细胞受到抗原刺激时,Ifng和Gzmb水平显著降低,Tnfa和Il2呈下降趋势。这些数据表明,短期饮食改变直接损害外周抗原特异性CD4+ T细胞的效应功能。(见图3)
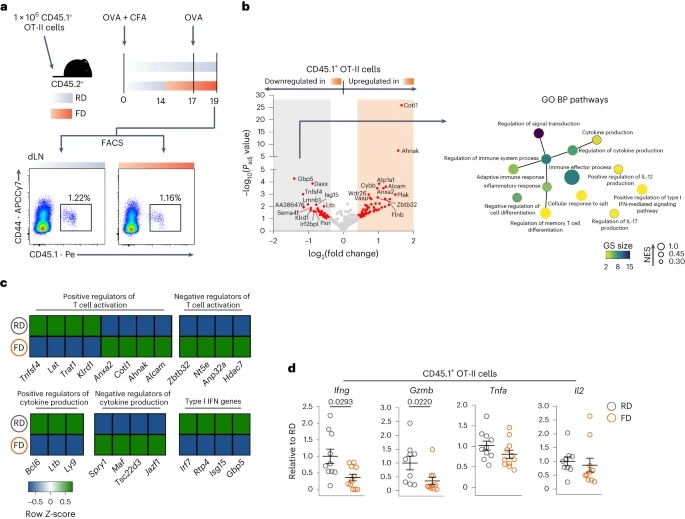
图3. 短期摄入FD会损害抗原特异性CD4+ T细胞
为了确定FD驱动的效应是否是由于更高的热量摄入导致的,切换到FD时,研究者保证了和RD喂养小鼠同样的卡路里消耗(即成对喂养)。切换到FD的成对喂养小鼠没有增加体重,并且与自由切换到FD的小鼠具有相似的血清胆固醇水平和相似的Il17a和Il17f水平。同样的结果也出现在另一种不同的能量密集饮食中,这种饮食含有高水平的糖,低纤维,但不添加脂肪。此外,喂食低脂肪、纤维含量低于0.3%饮食的小鼠,PP TH17细胞比例显著低于高纤维饮食。这些数据表明,短期饮食变化的影响并不依赖于脂肪,而是纤维。由于肠道菌群可以将膳食纤维分解为其代谢物,并对短期饮食变化做出快速反应,研究者推测FD驱动的效应由肠道菌群介导。因此,在无菌小鼠中进行了实验。FD无菌小鼠回肠的Il17a和Il17f水平低于RD无菌小鼠。这表明,肠道III型免疫抑制依赖于肠道微生物群的组成,而肠道微生物群的组成在短期饮食转换为FD后发生了变化。介导免疫稳态的关键细菌种类是那些将膳食纤维发酵成短链脂肪酸(SCFAs)的细菌,而FD与RD的主要区别之一是FD中膳食纤维的含量较低。后研究者发现切换到FD的SPF小鼠的回肠内容物中,参与C2(乙酸)和C4(丁酸)合成的途径显着下调。盲肠C2和C4浓度也较低。肠道Il17a和Il17f基因表达水平与C2和C4浓度呈正相关。这些数据表明,FD驱动的效应不是由脂肪或卡路里摄入介导的,而是由肠道微生物群介导的。(见图4)
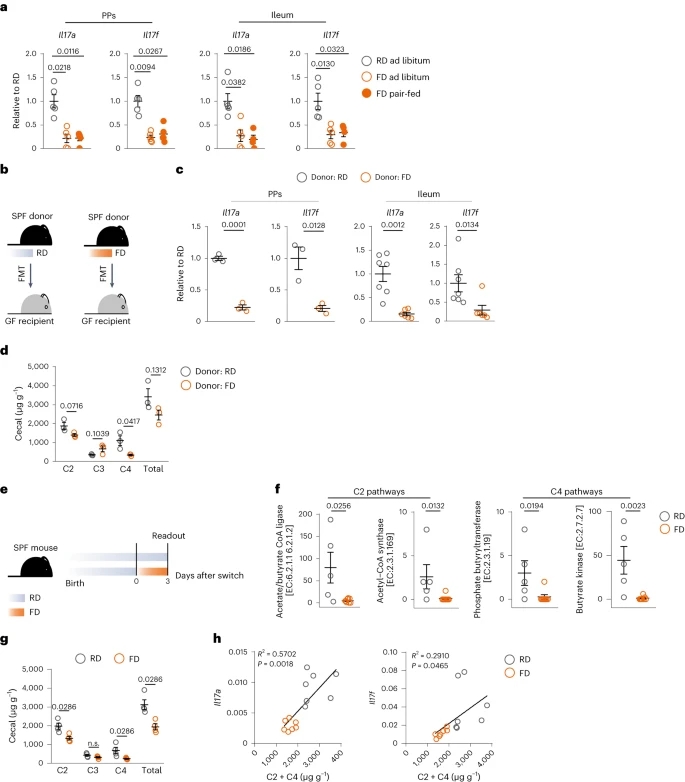
图4. 短期FD饮食的影响是由微生物代谢物介导的
故研究者假设SCFAs的减少可能通过改变I型和III型免疫反应共有的基本机制(如CD4+ T细胞代谢)来驱动FD介导的肠道和全身免疫损伤。研究者从切换到FD的小鼠的PPs和脾脏中分离细胞,并评估它们的代谢适应度。结果显示在切换到FD后,PP CD4+ T细胞表现出氧化磷酸化(OXPHO)、mTOR和糖酵解通路显著下调。由于CD4+ T细胞的代谢和分泌效应细胞因子的能力与TCR(T cell receptor)密切相关,研究者在体外用抗CD3 /抗CD28激活PP CD4+ T细胞。结果发现,切换到FD的小鼠的PP CD4+ T细胞在TCR触发后表现出较低的线粒体适应度。在TCR刺激下,下游mTOR通路也受到FD的影响,磷酸化核糖体蛋白S6(p-rS6)的表达显著降低,这是mTOR通路的关键靶点。由于SCFAs在切换到FD后减少,可以通过抑制组蛋白去乙酰化酶(HDAC)来增强mTOR信号通路,从而促进细胞因子的产生,因此研究者用C2 + C4或HDAC抑制剂trichostatin A (TSA)处理FD条件下的PP CD4+ T细胞。使用的C2和C4浓度没有导致细胞死亡。C2 + C4和TSA均增加了切换到FD的小鼠PP CD4+ T细胞的rS6磷酸化,而添加雷帕霉素(mTOR抑制剂)则消除了它们的作用。C2 + C4处理或TSA处理也促进了FD饮食小鼠PP CD4+ T细胞的线粒体适应度。IL17A、IL17F和TNFα的分泌也增加了,这些作用通过添加雷帕霉素而消除。这些数据表明,短期切换到FD与SCFAs的快速减少有关,损害了粘膜CD4+ T细胞的mTOR活性和线粒体功能。与PP CD4+ T细胞的结果一致,FD小鼠的外周血CD4+ T细胞比RD小鼠的外周血CD4+ T细胞显示出更高的基线耗氧量。在体外用寡霉素处理从RD供体中分离的OT-II细胞,消除了局部足垫肿胀。此外,用C2 + C4体外处理FD喂养小鼠的OT-II细胞可提高其诱导适当的足垫肿胀的能力,雷帕霉素会消除这种效果。由此可见,短期FD饮食会损害CD4+ T细胞的代谢适应度。(见图5)
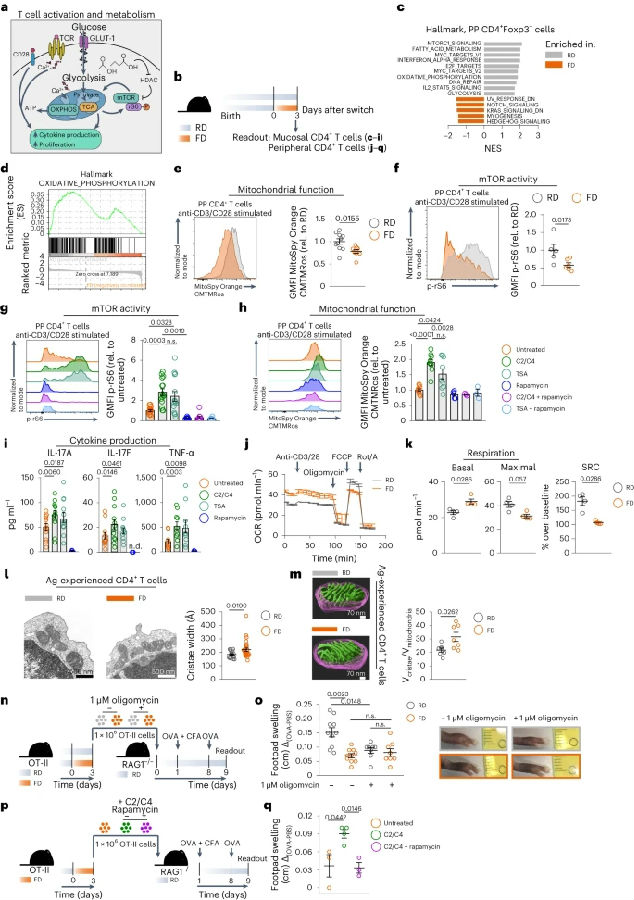
图5. 短期FD饮食会损害CD4+ T细胞的代谢适应度
由于数据显示饮食行为和免疫途径之间的同步性和强相关性,研究者假设重新引入RD足以恢复有效的免疫。因此,研究者在FD小鼠食用FD期间加入OVA,然后切换回RD,并在切换到RD后的7天或21天进行检测。结果发现在切换回RD至少21天的小鼠中,能恢复诱导足垫肿胀,而在仅经历RD 7天的小鼠中,不能诱导足垫肿胀。接下来,研究者直接添加C2和C4。虽然结果表明不如切换回RD有效,但足以部分挽救FD驱动的全身免疫抑制。此外,添加C2和C4的FD也足以改善FD喂养小鼠对鼠伤寒沙门氏菌的敏感性。这些数据表明,FD导致的粘膜和全身免疫损伤是短暂的,可以通过切换回富含纤维的饮食来恢复。(见图6)

图6. 重新引入膳食纤维可恢复黏膜和全身免疫
最后,研究团队对人类志愿者进行饮食干预,同样证实短期的饮食变化会引起黏膜和全身免疫的短暂抑制。健康志愿者摄入富含纤维的食物(FRD)5天,然后切换到缺乏纤维的饮食(FPD)5天。结果发现切换到FPD后改变了志愿者肠道微生物群的组成,显著减少了纤维发酵细菌的丰度。人肠道中主要的C4产生菌也因食用FPD而显著减少。从FRD切换到FPD后,粪便中SCFAs(包括C2和C4)的浓度显著降低。此外,摄入FPD后,志愿者外周血中共表达IL17A和TNFα的全身TH17细胞和TH1细胞显著减少。(见图7)

图7. 人短期食用低纤维食物
综上,短期缺乏纤维的饮食会引起黏膜和全身免疫的短暂抑制,可能会导致致病性感染。补充纤维代谢物可以显著改善I型和III型免疫反应,但与重新引入富含纤维的饮食的程度不同。这表明其他饮食成分可能在促进免疫方面发挥额外作用,值得进一步研究。此外,应该考虑适当的饮食,以最大限度地发挥疫苗和免疫疗法的功效。
云克隆开发了与该研究相关的靶标产品,部分指标节选如下:

更多信息,欢迎访问:http://www.cloud-clone.cn/