免疫调控新发现:CMTM6通过调节CD58和PD-L1的蛋白表达影响T细胞抗肿瘤反应
众所周知,T细胞在肿瘤免疫防御体系中发挥关键作用,但由于它的激活往往受到抑制性和刺激性免疫检查点的控制,因此免疫检查点分子的表达紊乱会助力癌细胞的免疫逃逸。虽然阻断PD-L1等抑制性免疫检查点蛋白是目前大多数癌症免疫疗法的重要靶标,但免疫共刺激信号的缺乏可能会使这些疗法收效甚微甚至毫无用处。
CD58是一种共刺激配体,在细胞的抗肿瘤免疫应答中起着至关重要的作用,但控制其表达的机制尚不明朗。近日,发表在《Cancer Cell》上题为“CMTM6 shapes antitumor T cell response through modulating protein expression of CD58 and PD-L1”的研究发现,CMTM6可以同时正向调控免疫共刺激因子CD58和免疫共抑制因子PD-L1,进而影响T细胞的抗肿瘤反应。这无疑为新型免疫疗法的开发打开了新思路。

图1. 研究思路示意图(图片源自《Cancer Cell》)
CMTM6在肿瘤细胞中共同调控CD58和PD-L1
前期研究发现CMTM6是PD-L1的正调节因子和分子伴侣,基于此作者定量分析了CMTM6缺失和CMTM6正常表达肿瘤细胞的总蛋白质组。发现在CMTM6缺陷细胞中,除了PD-L1表达降低外,CD58(LFA-3)也显著下调。
鉴于CD58在抗肿瘤免疫应答中的关键作用,作者进行了基于FACS的单倍体遗传筛选,以系统地鉴定该蛋白的调控者。结果发现在CD58low细胞群体中CD58位点的破坏性插入高度富集。此外,鉴定出糖基磷脂酰肌醇(GPI)生物合成途径的组分和内质网转位复合物是CD58表达的调节因子,而CMTM6也是其中最重要的调节因子之一。
为了验证这一发现,作者敲除了HAP1细胞系中的CMTM6。发现与亲代HAP1细胞相比,CMTM6缺陷细胞表面CD58表达降低。此外,在CMTM6缺陷细胞中重新加入CMTM6表达可以恢复CD58的表达。
上述比较蛋白质组学分析和单倍体遗传筛选均显示CMTM6是CD58免疫检查点的正调节因子。
由于CMTM6先前已被证明维持PD-L1蛋白的表达,综合上述结果研究者提出了一个大胆假设:共刺激和共抑制免疫检查点配体的表达由相同的调节蛋白控制。
为了验证这一假设,作者在多种癌症类型的细胞系中进行了CMTM6的缺失和重构,包括8505C甲状腺癌细胞、A375黑色素瘤细胞和RKO结直肠癌细胞。在A375细胞中,IFNγ诱导PD-L1表达,而CD58表达不受细胞因子暴露的影响。CRISPR-Cas9破坏CMTM6会降低细胞表面CD58和PD-L1的总蛋白水平。相反,CMTM6的重组恢复了两种免疫检查点配体的表达。在CD58和PD-L1基础表达水平较高的8505C和RKO细胞中,CMTM6缺失同时下调了这两种免疫检查点配体,而重新引入CMTM6则恢复了这种表型。


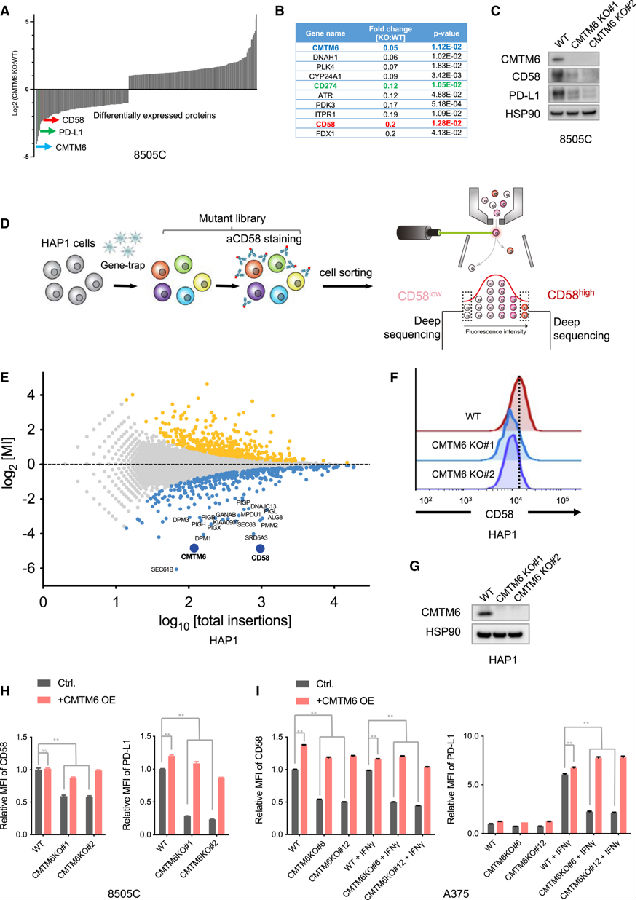
图2. CMTM6在肿瘤细胞中共同调控CD58和PD-L1(图片源自《Cancer Cell》)
CMTM6维持CD58蛋白的稳定性并与之相互作用
为探究CMTM6介导的CD58调控机制,研究者首先比较了CMTM6缺乏和正常表达细胞中CD58的mRNA水平。发现CMTM6缺失不会降低CD58的RNA转录物水平,但会显著降低细胞表面和总CD58蛋白水平,表明这种调控发生在转录后水平。由于CMTM6包含一个四元跨越的MARVEL(MAL)结构域以及用于囊泡运输和膜连接的相关蛋白,能促进PD-L1的内吞循环并保护PDL1免于泛素化。基于此作者推测CMTM6可以通过类似的机制调节CD58的表达。为了研究这一点,他们用别藻蓝蛋白(allophycocyanin, APC)偶联CD58特异性抗体标记细胞表面表达的CD58,追踪和定量APC信号随时间的变化。分析显示,在CMTM6缺失的情况下,细胞表面CD58的衰减速度更快。
在真核细胞中,蛋白质降解主要通过蛋白酶体和溶酶体蛋白水解途径发生。随后,研究者们用蛋白酶体或溶酶体酸化抑制剂孵育细胞。发现两种抑制剂都延迟了荧光信号的衰减。值得注意的是,溶酶体抑制显著降低了CMTM6缺陷细胞中CD58的降解率,其水平与CMTM6正常细胞相似。这些结果表明CMTM6保护细胞表面CD58免受溶酶体介导的降解。
由于CMTM6与PDL1和CD58共定位并调节其稳定性,研究者接下来评估了这三种分子之间可能的相互作用。他们用抗CMTM6、抗CD58和抗PD-L1抗体进行了免疫共沉淀和免疫印迹分析。在A375细胞裂解物的抗CMTM6免疫沉淀中,检测到CD58和PD-L1。同样,CMTM6也存在于抗CD58和抗PD-L1免疫沉淀中。然而,在抗CD58免疫沉淀中未检测到PD-L1,反之亦然。因此,表明CD58和PD-L1之间不存在直接的相互作用。随后,作者又通过细胞表面免疫沉淀实验来确定CMTM6是否与细胞表面PD-L1和CD58分子相互作用,发现PD-L1水平在CD58缺失的A375细胞中略有升高。随着PDL1水平的升高,PD-L1与CMTM6之间的关联增加。相比之下,肿瘤细胞中PD-L1的缺失并没有导致CD58水平或CMTM6/CD58相互作用的明显增加。
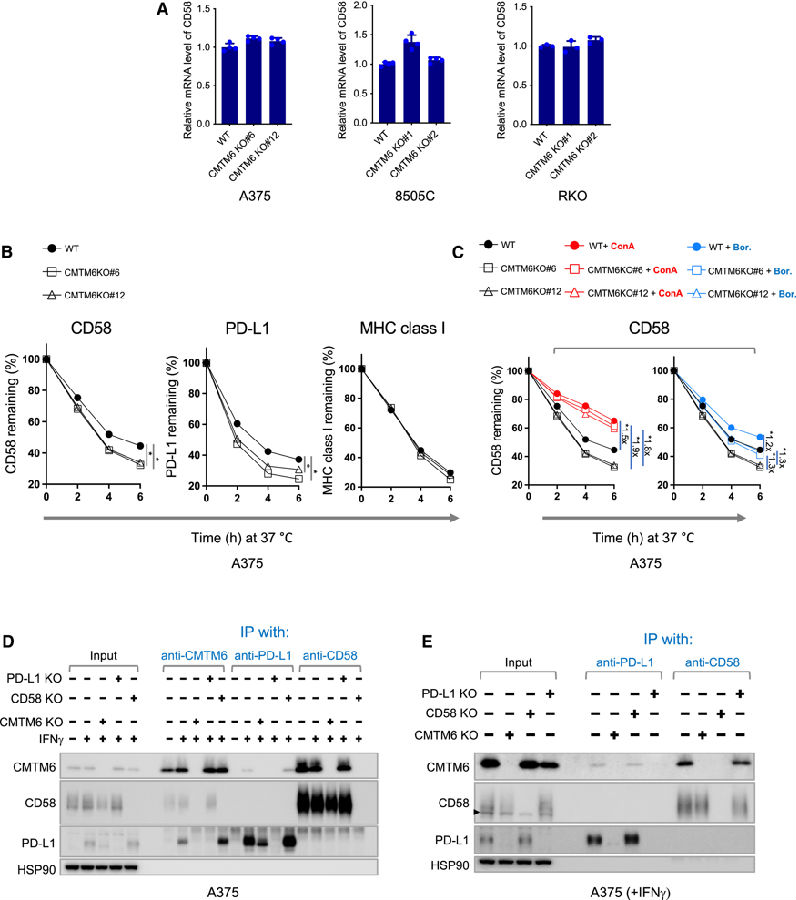

图3. CMTM6促进细胞表面CD58的稳定性并与之互作(图片源自《Cancer Cell》)
CMTM6和CD58在T细胞激活和T细胞-肿瘤互作中的作用
研究者进一步评估了肿瘤细胞中CMTM6对T细胞激活的影响。他们共培养了由T细胞1(MART-1)抗原负载的肿瘤细胞识别的黑色素瘤抗原和用MART-1特异性T细胞受体转导的T细胞。在肿瘤识别后,T细胞显示出激活标记物(CD137、CD69、IL-2和TNF-a)的表达增加。此外,PD-L1阻断进一步增强了T细胞的活化,而CD58阻断具有相反的效果。
通过这种共培养模型,他们发现,与野生型和CMTM6重组的肿瘤细胞相比,和CMTM6敲除的肿瘤细胞孵育显著降低了T细胞激活标志物(CD137和CD69)和T细胞效应因子(IL-2和TNFa)的表达。同样,CMTM6缺失导致肿瘤细胞活力显著增加。
考虑到CMTM6在维持细胞表面CD58和PD-L1表达中的双重作用,作者试图确定这两个在T细胞-肿瘤细胞相互作用中具有相反功能的免疫检查点的相对重要性。值得注意的是,当CD58和PD-L1同时被阻断时,在CD2high和PD-1+T细胞群中,单独阻断PD-L1所观察到的T细胞活化增强被完全消除。实际上,PD-L1和CD58的共抑制使CD2high和CD2inter T细胞的活化水平低于未处理的对照组,表明CD58阻断的主导作用。在A375和8505C细胞的共培养系统中,都观察到CD58阻断对T细胞活化的显著影响。上述数据表明,CD58在抗原特异性T细胞-肿瘤细胞相互作用和对PD-L1阻断的反应中起着至关重要的作用。
此外,他们还观察到A375或8505C细胞中CMTM6的缺失导致肿瘤细胞存活率增加。PD-L1抑制增强了T细胞对肿瘤细胞的杀伤,而CD58的抑制则显著挽救了肿瘤细胞。与CMTM6缺陷细胞相比。CD58敲除消除了CMTM6正常表达细胞和CMTM6缺乏细胞对肿瘤特异性T细胞和PD-L1阻断的差异反应。相反,当CD58在CMTM6缺陷和CMTM6正常表达的肿瘤细胞中过表达时,这些细胞的活力在与肿瘤反应性T细胞共培养后下降到一个相对稳定的水平。这些发现强调了CD58在抗原特异性T细胞-肿瘤细胞相互作用和PD-L1阻断反应中的重要作用,CMTM6介导的CD58调控在此背景下发挥了重要作用。


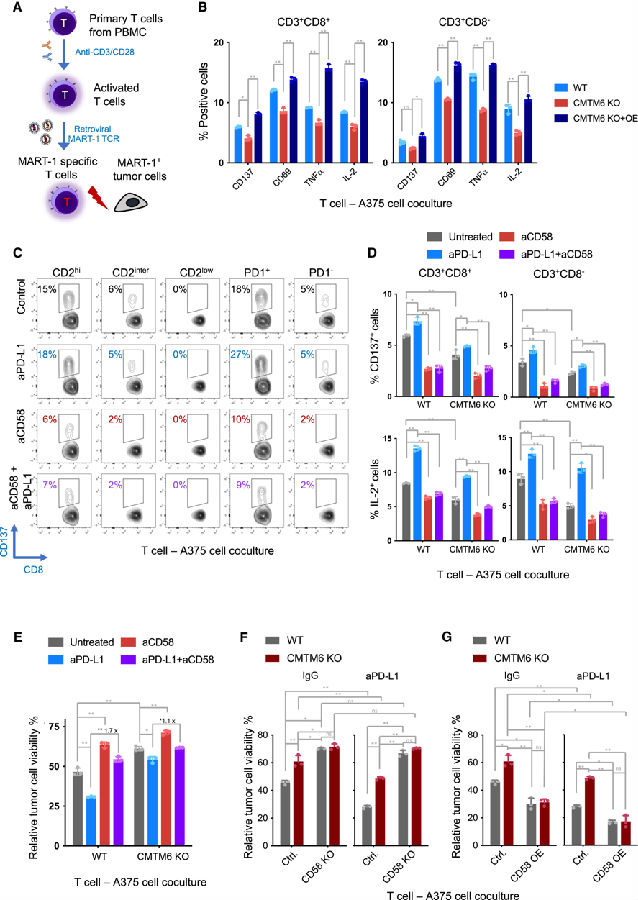
图4. CMTM6、CD58和PD-L1对抗原特异性T细胞-肿瘤细胞相互作用的影响
(图片源自《Cancer Cell》)
CMTM6和CD58在肿瘤细胞中的表达与ICB治疗的临床反应呈正相关
为了研究人类癌症中CMTM6和CD58表达之间的关系,研究者们使用CMTM6或CD58的抗体对88个黑色素瘤样本和102个结肠癌样本进行了免疫组织化学(IHC)分析。结果显示,CMTM6和CD58在两种癌症类型样本的肿瘤细胞中广泛分布且大部分重叠表达(4C)。他们观察到在88个黑素瘤中有77个的CD58染色主要出现在的CMTM6表达区域。此外,他们对CMTM6和CD58在肿瘤细胞上的蛋白表达水平进行了量化,发现它们在肿瘤细胞中的表达存在显著相关性。
为了评估CMTM6和CD58表达与ICB治疗反应之间的关系,他们分析了88例晚期黑色素瘤患者的肿瘤活检。这些患者随后接受了抗PD-1或抗PD-1/抗CTLA4治疗。结果显示CMTM6或CD58在这些治疗组之间的表达无显著差异。同时,较高水平的CMTM6或CD58表达与对ICB治疗的有利反应显著相关。这些发现强调了CMTM6介导的CD58调控在人类肿瘤中的相关性,并提示其在调节对ICB治疗的反应中可能起着关键作用。

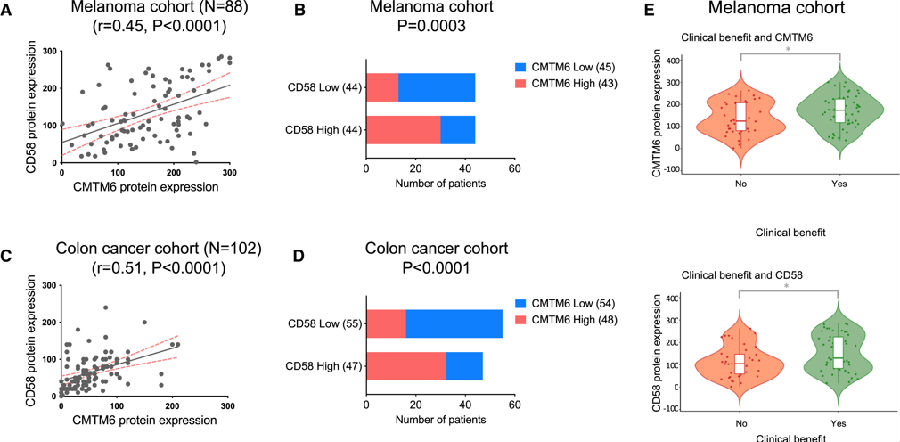
图5. 肿瘤细胞中CMTM6调控CD58表达以及它们与ICB治疗反应之间的关系
(图片源自《Cancer Cell》)
免疫检查点通路在TME中经常失调,从而促进癌症的进一步发展并造成免疫治疗的耐药性。因此,解码调节免疫检查点分子的分子机制对于理解癌症中的免疫调节至关重要,并且可能预测免疫检查点疗法的反应并提供新的治疗途径。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力肿瘤治疗相关研究,部分指标节选如下,供参考:
指标名 | 核心货号 | 指标名 | 核心货号 |
CD58 | A903 | SRD5A2 | M582 |
PDL1 | A788 | PLK3 | G785 |
CD2 | B576 | CYP24A1 | D543 |
PD1 | A751 | ATR | D751 |
CTLA4 | B230 | PDK3 | D463 |
EZH2 | K073 | ITPR1 | E845 |
FDX1 | C475 | TNFA | A133 |
IL-2 | A073 | IFNg | A049 |
更多信息,欢迎访问http://www.cloud-clone.com/。