银屑病疾病机制研究新发现
银屑病是一种常见的慢性皮肤病,影响全球2-3%的人口。其特征是界限分明,覆盖着银白色鳞片的红色斑块,通常以对称分布发生,累及肘部、膝盖、躯干和头皮。患有银屑病的人患其他慢性和严重健康疾病的风险增加,包括银屑病关节炎、代谢综合征、心血管疾病和其他一些疾病,如焦虑和抑郁、非酒精性脂肪性肝病、克罗恩病和淋巴瘤等。遗传因素在银屑病的发展中起着关键作用,而环境因素会加剧银屑病。目前,银屑病治疗选择包括局部皮质类固醇、维生素D类似物、钙调神经磷酸酶抑制剂、角膜溶解剂、靶向光疗法以及生物制剂。尽管银屑病的系统治疗已经取得了相当大的进展,但对更有效和更安全的治疗需求仍然没有得到满足。近期,多篇文献报道了银屑病发病机制相关研究,可能为进一步改善患者预后提供帮助。
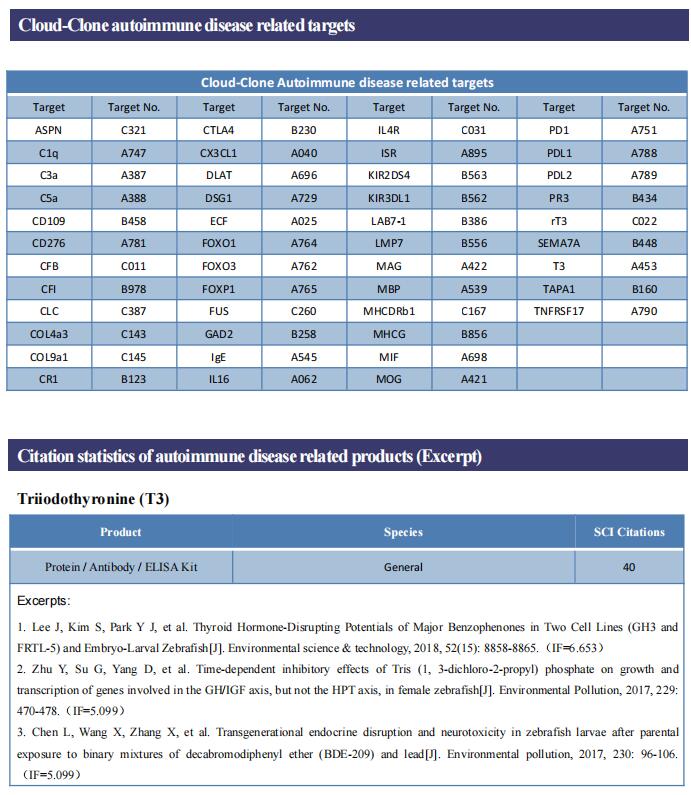
1. FXYD3通过竞争性结合角质形成细胞中的TRAF3增强IL-17A信号传导以促进银屑病
FXYD3,也称为Mat-8,属于FXYD蛋白家族,主要在皮肤、结肠、胃和子宫中表达。FXYD3在银屑病等皮肤病中的病理作用和机制在很大程度上仍然未知。浙江大学医学院免疫学研究所Qingqing Wang团队发现FXYD3的表达在银屑病患者和咪喹莫特(IMQ)诱导的银屑病小鼠的病变皮肤中显著增加[1]。IL-17A是一种对银屑病病变发展很重要的细胞因子,有助于人类原代角质形成细胞中FXYD3的表达。在IMQ诱导的银屑病模型中,角质形成细胞中的FXYD3缺失减弱了银屑病样表型和炎症。FXYD3通过与IL-17R竞争结合TRAF3来促进IL-17R-ACT1复合物的形成,然后增强角质形成细胞中的IL-17A信号传导(图1)。这促进了NF-κB和MAPK信号通路的激活,并导致促炎因子的表达。这项研究阐明了FXYD3在角质形成细胞中作为IL-17A信号传导的介质以形成促进银屑病恶化的阳性调节环的机制,靶向FXYD3可能是治疗银屑病的一种潜在治疗方法。
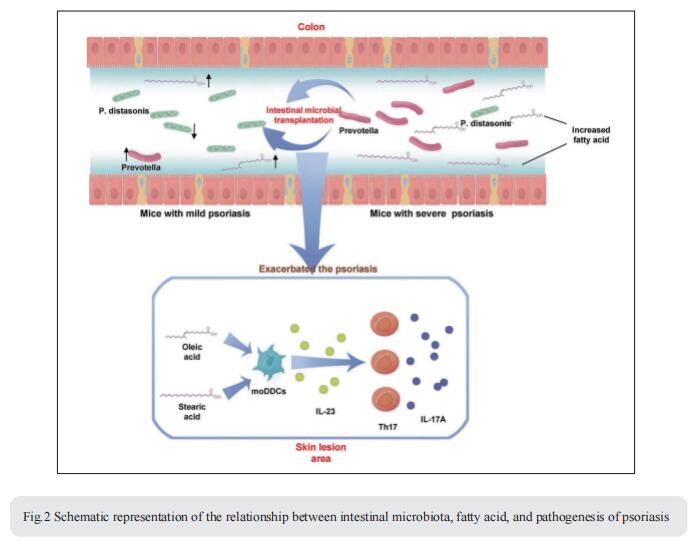
2. 肠道微生态失调通过脂肪酸代谢的变化加剧银屑病样表型
肠道微生物群与宿主免疫以及银屑病有关。然而,肠道微生物群调节银屑病的机制还需要系统地论证。四川大学华西医院生物治疗与癌症中心国家重点实验室Jiong Li团队发现银屑病样皮肤表型的严重程度伴随着肠道微生物群组成的变化[2]。他们使用K14-VEGF转基因银屑病小鼠模型进行了共窝和粪便微生物移植(FMT)实验,并证明来自严重银屑病样皮肤表型小鼠的肠道微生物群的移植加剧了具有轻度症状小鼠的银屑病样皮肤炎症,包括增加Th17的浸润和分化,并增加了结肠中普雷沃氏菌的丰度,同时降低了Parabacteroides distasonis的丰度。这些变化影响了脂肪酸代谢,增加了油酸和硬脂酸的丰度。庆大霉素治疗显著降低了K14-VEGF小鼠和IMQ诱导的银屑病样小鼠的普雷沃氏菌丰度,缓解了银屑病样症状。此外,油酸和硬脂酸的使用加重了银屑病样症状,增加了体内皮肤病变区域的Th17和单核细胞来源的树突状细胞(DC)浸润,并在体外通过刺激DC增加了IL-23的分泌(图2)。PDE-4抑制剂的治疗减轻了K14-VEGF小鼠的银屑病样表型,并伴随着肠道微生物群的恢复,包括普雷沃氏菌的减少和Parabacteroides distasonis的增加。这些研究结果表明,肠道微生物群调节宿主代谢和银屑病样皮肤炎症,为银屑病的临床诊断和治疗提供了一个新的靶点。
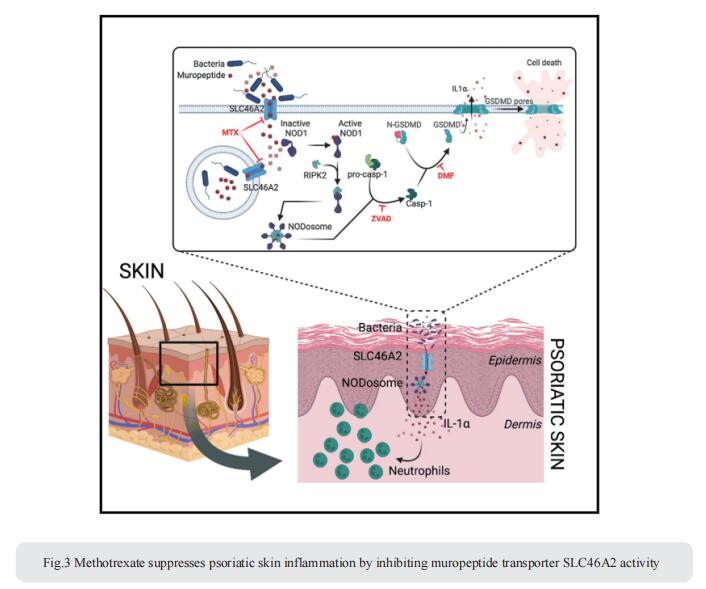
3. 甲氨蝶呤通过抑制胞壁肽转运蛋白SLC46A2活性抑制银屑病皮肤炎症
与肠道微生物组类似,皮肤微生物组不断与表皮相互作用,调节局部和全身免疫反应,并与银屑病等炎症性皮肤病有关。NOD1和NOD2是抗细菌免疫的关键模式识别受体,它们通过识别细菌胞壁成分肽聚糖来介导免疫应答信号途径活化发挥重要作用。然而,NOD1/2传感在银屑病中的作用尚不清楚。美国马萨诸塞大学陈氏医学院先天免疫和传染病与免疫学系Neal Silverman团队重点研究了Slc46a2,在哺乳动物表皮角质形成细胞中高表达,并表明它对角化细胞中二氨基庚二酸(DAP)胞壁肽的递送和NOD1的激活至关重要,而相关转运体Slc46a3在将NOD2配体胞壁酰二肽(MDP)递送到角化细胞中至关重要[3]。在小鼠银屑病模型中,Slc46a2和Nod1缺乏强烈抑制银屑病炎症,而常用的银屑病治疗药物甲氨蝶呤抑制DAP胞壁肽的Slc46a2依赖性转运(图3)。这些研究将SLC46A2定义为胞壁肽激活NOD1的转运蛋白,在皮肤屏障中具有关键作用,并将该转运蛋白确定为抗炎干预的重要靶点。
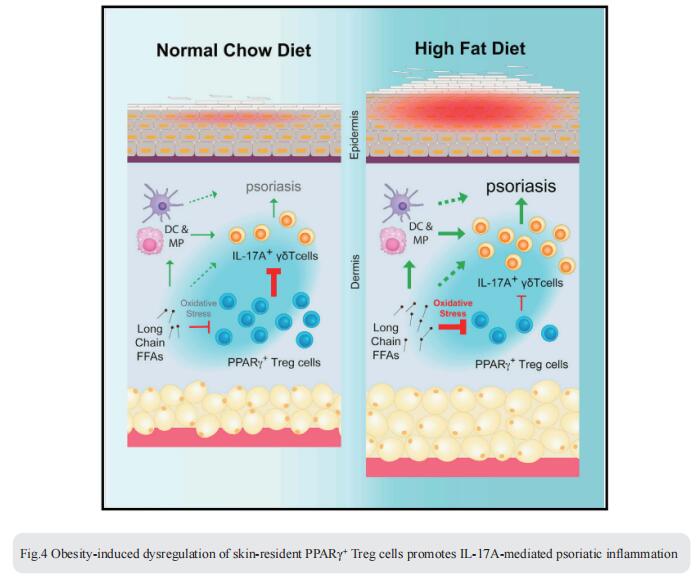
4. 肥胖诱导的皮肤固有PPARγ+Treg细胞失调促进IL-17介导的银屑病炎症
肥胖是银屑病的主要风险因素,但肥胖如何破坏控制皮肤炎症的调节机制尚不清楚。美国埃默里大学医学院微生物学和免疫学系Chaoran Li团队发现皮肤富含独特的CD4+ Foxp3+表达核受体过氧化物酶体增殖激活受体γ(PPARγ)的调节性T(Treg)细胞群[4]。PPARγ驱动了IL-17A+γδ T细胞介导的银屑病炎症的独特转录程序和功能抑制。然而,饮食诱导的肥胖导致PPARγ+皮肤Treg细胞减少,并相应失去对IL-17A+γδ T细胞介导的炎症的控制。从机制上讲,PPARγ+皮肤Treg细胞在肥胖小鼠中优先吸收高水平的长链游离脂肪酸,这导致细胞脂毒性、氧化应激和线粒体功能障碍(图4)。这些PPARγ+皮肤Treg细胞的抗炎特性可能对肥胖相关的炎症性皮肤病具有治疗潜力。
参考文献
[1]Yang W, He R, Qu H, et al. FXYD3 enhances IL-17A signaling to promote psoriasis by competitively binding TRAF3 in keratinocytes [J]. Cell Mol Immunol. 2023;20(3):292-304. (IF=24.1)
[2]Zhao Q, Yu J, Zhou H, et al. Intestinal dysbiosis exacerbates the pathogenesis of psoriasis-like phenotype through changes in fatty acid metabolism [J]. Signal Transduct Target Ther. 2023;8(1):40. (IF=39.3)
[3]Bharadwaj R, Lusi CF, Mashayekh S, et al. Methotrexate suppresses psoriatic skin inflammation by inhibiting muropeptide transporter SLC46A2 activity [J]. Immunity. 2023;56(5):998-1012.e8. (IF=32.4)
[4]Sivasami P, Elkins C, Diaz-Saldana PP, et al. Obesity-induced dysregulation of skin-resident PPARγ+ Treg cells promotes IL-17A-mediated psoriatic inflammation [J]. Immunity. 2023;56(8):1844-1861.e6. (IF=32.4)
云克隆不仅可提供多种自身免疫疾病动物模型,包括银屑病、重症肌无力、变态反应性脑脊髓炎、干燥综合征、系统性红斑狼疮、类风湿性关节炎等,涵盖常见自身免疫疾病;还具有各类自身免疫疾病检测指标及上述IL-17A、TRAF3、NOD1、NOD2、PPARγ等相关产品,可助力广大科研工作者进行自身免疫疾病研究。