文献解读 | 先导编辑精确校正干间质细胞Lhcgr突变挽救小鼠遗传性原发性性腺功能低下

2023年9月11日,中山大学中山医学院项鹏团队联合中山大学附属第一医院邓春华团队在《Advanced Science》上发表题为“Precise Correction of Lhcgr Mutation in Stem Leydig Cells by Prime Editing Rescues Hereditary Primary Hypogonadism in Mice”的文章,他们的研究结果表明,基于先导编辑的睾丸间质干细胞离体编辑是一种很有前途的遗传性原发性性腺功能减退症治疗策略。

在这篇文章中,云克隆试剂盒【黄体激素(LH)检测试剂盒(酶联免疫吸附试验法),CEA441Mu;促卵泡素(FSH)检测试剂盒(酶联免疫吸附试验法),CEA830Mu】受到科研工作者的认可,荣登优秀国际期刊。

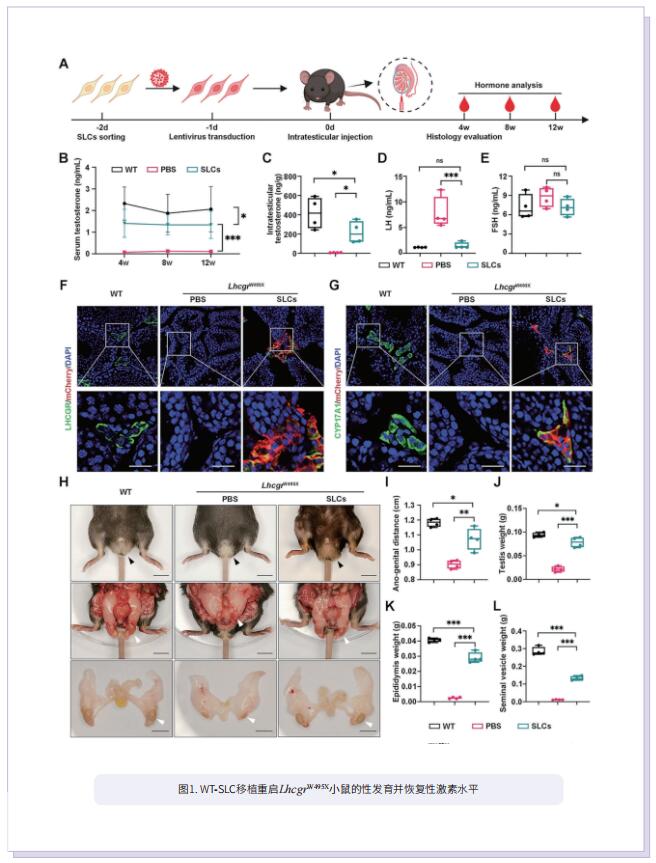
睾丸间质细胞(LC)位于睾丸间质室,位于曲精小管之间,主要负责睾酮的产生。因此,LC对于男性表型、内分泌稳态和生殖功能的发展和维持是必不可少的。遗传性原发性性腺功能减退症(HPH)是由损害LC功能的遗传原因导致的,这种疾病的特点是睾酮水平低或缺乏,促性腺激素水平高,男性表型不全,精子发生严重受损。黄体生成素/绒毛膜促性腺激素受体(LHCGR)在LC分化和睾酮合成中起重要作用。Lhcgr突变导致睾酮缺乏,进而导致性发育受损、精子发生受阻和不育,是HPH的原型。睾酮替代疗法(TRT)是治疗HPH的首选,因为外源性TRT可以在很大程度上逆转低血清睾酮水平,并部分改善性腺功能减退相关症状。然而,外源性TRT会引起许多不良反应,如睡眠呼吸暂停、中风、心脏病发作和前列腺肿瘤发生。因此,迫切需要开发更安全的HPH治疗方法。
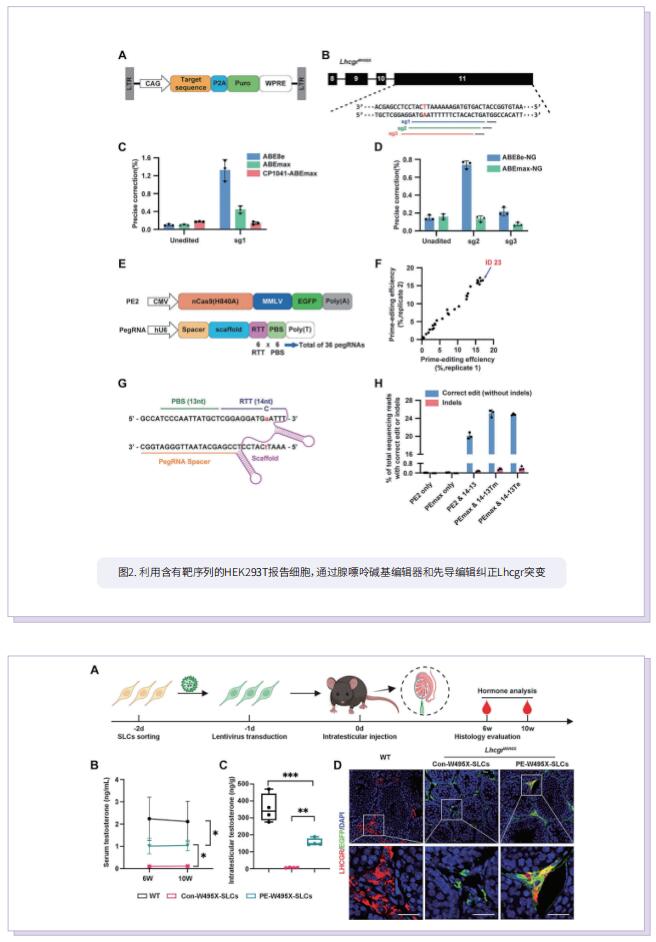
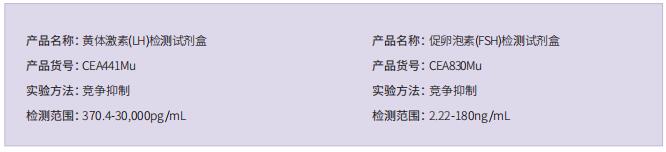
干间质细胞(SLC)能够通过增殖和分化再生新的LC,在维持成年睾丸的LC稳态中发挥着关键作用。SLC移植可能是治疗男性原发性性腺功能减退症的一种很有前途的方法。然而,由于HPH患者SLC的遗传性基因缺陷,无法实现SLC移植。基因编辑干细胞衍生细胞在临床前和临床研究中的大规模应用表明,一旦SLC中性腺功能减退诱导的基因突变得到纠正,它们就可能适合于自体移植,通过分化为功能性LC来拯救HPH。在这项研究中,作者首先基于在HPH患者中观察到的Lhcgr的无义点突变生成了LhcgrW495X突变小鼠模型。为了验证SLC移植治疗HPH的疗效和可行性,将野生型SLC移植到LhcgrW495X小鼠中,其中SLC明显挽救了HPH表型。通过比较几种编辑策略,优化的基于先导编辑的PE2蛋白(PEmax)系统被认为是纠正Lhcgr致病点突变的一种有效而精确的方法。此外,通过慢病毒传递内部分裂的PEmax系统成功地在体外纠正了LhcgrW495X小鼠SLC中的突变。LhcgrW495X小鼠的基因校正SLC在体外表现出向功能性间质细胞分化的能力。值得注意的是,在LhcgrW495X小鼠中,基因校正的SLC移植有效地再生了间质细胞,恢复了睾丸激素的产生,重启了性发育,挽救了精子发生,并产生了可育的后代。
综上所述,这项结果表明,在离体SLC中基于先导编辑的基因编辑是一种很有前途的HPH治疗策略,并且有可能用于治疗生殖系统中的更多遗传性疾病。