Nature:干扰素-ε是一种肿瘤抑制因子,可抑制卵巢癌
2023年8月16日,澳大利亚哈德逊医学研究所及蒙纳士大学的研究团队在《Nature》期刊发表了题为“Interferon-ε is a tumour suppressor and restricts ovarian cancer”的文章。该研究表明:IFNε在输卵管上皮细胞(高级别浆液性卵巢癌的起源细胞)中组成性表达,然后在这些肿瘤的发展过程中消失。IFNε抗肿瘤活性机制直接作用于肿瘤细胞,激活抗肿瘤免疫。IFNε能激活抗肿瘤T细胞和自然杀伤细胞,阻止髓源性抑制细胞和调节性T细胞的积累和激活。

高级别浆液性卵巢癌(HGSOC)是卵巢癌的最常见形式,生存率较低(低于50%),因其出现时间较晚,伴有广泛的腹膜转移和化学耐药性,急需新的治疗方法。IFNε是I型IFN家族抗肿瘤细胞因子的一员,在女性生殖道(FRT)上皮中表达,调节对感染的免疫,但其抗肿瘤活性尚不清楚。IFNε可结合受体IFNAR1和IFNAR2激活JAK-STAT信号通路。从机制上讲,IFNε的独特特性体现在其对衣原体感染的保护中,它通过直接的抗微生物作用和调节局部粘膜免疫反应(在这种情况下是自然杀伤细胞)来抵抗衣原体感染。这与传统的I型IFNs(IFNα和IFNβ)形成鲜明对比,后者通过与T细胞相关的不同机制驱动衣原体感染的发病机制。事实上,IFNε与传统IFNs有许多不同之处,包括其上皮表达、激素调控及缺乏模式识别受体通路的调节,这些通路诱导传统IFNs对病原体或癌症中可能产生的“危险”信号做出反应。而这篇研究证明了IFNε具有保守的、跨物种的内在抗肿瘤特性,它在输卵管上皮中组成性表达,在卵巢肿瘤发生中表达缺失,证明IFNε是一种独特的肿瘤抑制因子。
免疫组化(IHC)染色显示IFNε在所有健康女性的FT上皮细胞中均有表达。这种IFNε蛋白表达模式在小鼠输卵管中是保守的,并且只检测到IFNε在上皮表达,其他IFNs几乎没测到。IFNε在低级别浆液性卵巢癌(LGSOC)和高级别浆液性卵巢癌(HGSOC)中表达水平显著降低。同样,在健康的FT上皮或肿瘤中均未检测到其他IFNs。用卵巢癌细胞系ID8建立了原位、同基因的HGSOC临床前模型。在注射细胞后,肿瘤在FT附近生长为“原发”肿瘤,并转移到腹膜腔,形成出血性腹水,继发性肿瘤沉积在横膈膜、腹膜壁和肠系膜上,类似于患有HGSOC的女性。结果表明,与野生型小鼠相比,在注射后6周,Ifne -/-小鼠的肿瘤扩散和腹腔转移性生长显著增加。在Ifne -/-小鼠中,某些腹膜免疫细胞群的总数也有所升高。这些数据表明IFNε具有许多内源性肿瘤抑制因子的特征。(见图1)
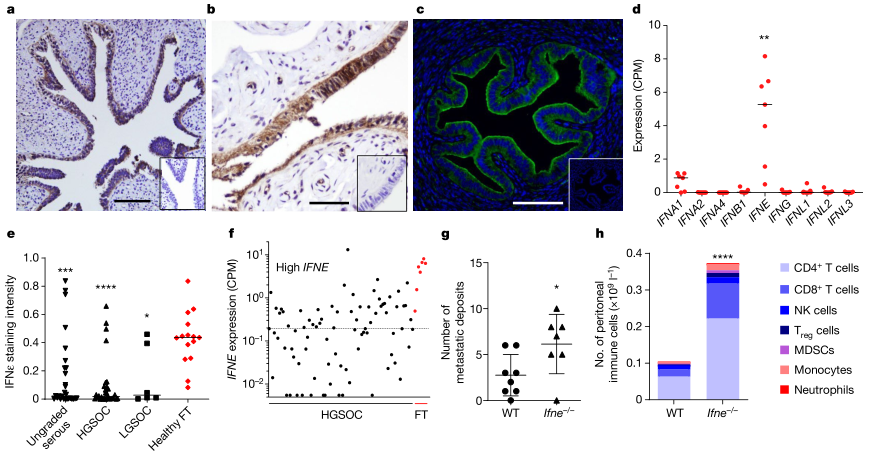
图1. IFNε在HGSOC中表达水平下降
(文中所有图片均来源于《Nature》杂志)
为了进一步了解IFNε的内在抗肿瘤特性和其潜在机制,研究者研究了重组IFNε在几个临床前模型中的作用。在ID8模型中,注射重组小鼠IFNε,蛋白呈剂量依赖性显著抑制腹膜转移瘤的生长。接种3天后注射IFNε抑制了这些“正在发展”的肿瘤。将IFNε处理的开始时间延迟4周以允许原位肿瘤形成,结果显示IFNε的总体疗效没有降低。为了研究IFNε对腹膜转移的影响,研究者在晚期卵巢癌模型中建立了腹膜转移模型,将ID8肿瘤细胞直接注射到腹膜腔中,之后它们在腹膜壁、腹膜器官和肠系膜上形成广泛的肿瘤沉积物,以及出血性恶性腹水,反映了女性晚期卵巢癌的表现。在该模型中,IFNε同样有效地抑制高肿瘤负荷,减少腹腔肿瘤生长和恶性出血性腹水的发展。(见图2)

图2. IFNε抑制发展中、已建立和晚期卵巢癌腹膜转移模型
从ID8模型小鼠中回收了经IFNε或PBS处理的腹膜渗出细胞(PECs),并将其与ID8细胞一起体外孵育。观察到ID8细胞与ifnε处理小鼠的腹膜细胞一起孵育后,细胞毒性CD8 + T和自然杀伤细胞的CD107a表达增加。IFNε显示出剂量依赖性诱导ID8细胞凋亡。通过xCELLigence和MTT检测,IFNε也显示出剂量依赖性的抗增殖作用。与上述在体内肿瘤模型中的观察结果一致,在体外实验中,IFNε比IFNβ更有效。然而,这些ID8肿瘤细胞的转录组学分析表明,IFNε并不是通过不同的基因介导这种作用,而是诱导了与IFNβ相同的基因,但其效力更高。随后,研究者研究了缺乏Ifnar1小鼠的肿瘤发展,Ifnar1编码所有I型IFNs的受体。在该模型中,宿主Ifnar1−/−细胞,包括免疫细胞,不能直接对IFNε产生应答,只有移植的Ifnar1 +/+ ID8肿瘤细胞才有应答。重组小鼠IFNε抑制了野生型和Ifnar1−/−小鼠的总体肿瘤转移负荷。Ifnar1 - / -小鼠肿瘤的显著减少表明IFNε对肿瘤细胞有直接作用,肿瘤细胞是唯一能够对IFN产生反应的细胞。然而,Ifnar1 - / -小鼠的肿瘤抑制综合评分明显低于野生型小鼠(约50%),表明在野生型小鼠中,IFNε抗肿瘤的间接作用(如抗肿瘤免疫应答)显著促进了IFNε的抗肿瘤作用。这些数据表明,IFNε能激活抗肿瘤免疫细胞,它也直接通过肿瘤细胞发挥其抗肿瘤作用。(见图3)
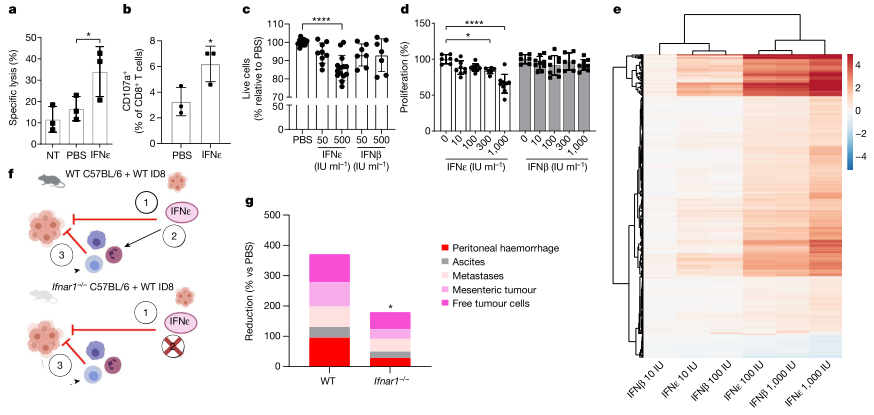
图3. IFNε抗肿瘤活性的机制
由于上述研究确定了IFNε在体外对肿瘤细胞的直接作用,研究者用初级HGSOC的两种病人来源肿瘤异种移植(patient-derived xenograft,PDX)模型(PDX183和PDX111)来测试在活体中,人IFNε对人肿瘤的直接作用。肿瘤移植到NSG小鼠中,将小鼠随机分为两组,分别接受重组人IFNε或PBS治疗,每周3次,持续6周。最后一次注射IFNε后24小时收集腹膜肿瘤细胞进行RNA测序分析,结果显示在HGSOC PDX111中诱导了强烈的应答反应,得到IFNε诱导(n = 105)和抑制(n = 11)基因,在HGSOC PDX183中,IFNε不调节基因表达,因此,从该模型衍生的肿瘤对IFNε的肿瘤生长抑制作用具有抗性。这两种肿瘤都有TP53突变,BRCA1和BRCA2没有突变,然而PDX183在RAD51C启动子上表现出纯合甲基化。接下来,研究者使用了晚期转移性ID8模型,其中Trp53和Brca2基因突变被CRISPR(ID8 TB)引入,更接近于人类肿瘤。在这个晚期HGSOC的同基因模型中,IFNε显示出对肿瘤生长高度有效的剂量依赖性抑制。通过1000 IU IFNε治疗,腹膜液中的“游离”肿瘤细胞几乎完全被消除。这些数据还表明,常见致癌基因Trp53和Brca2的突变不影响对IFNε的反应。用500 IU IFNε治疗可显著降低肿瘤生长,减少了约50%的腹膜淋巴细胞和骨髓细胞的细胞数量,MDSCs(髓源性抑制细胞)几乎完全消除。在剩余的细胞中,IFNε增加了活化的抗肿瘤效应细胞的比例,如CD8 +和CD4 + T细胞和表达活化标志物CD69和PD-1的自然杀伤细胞。(见图4)
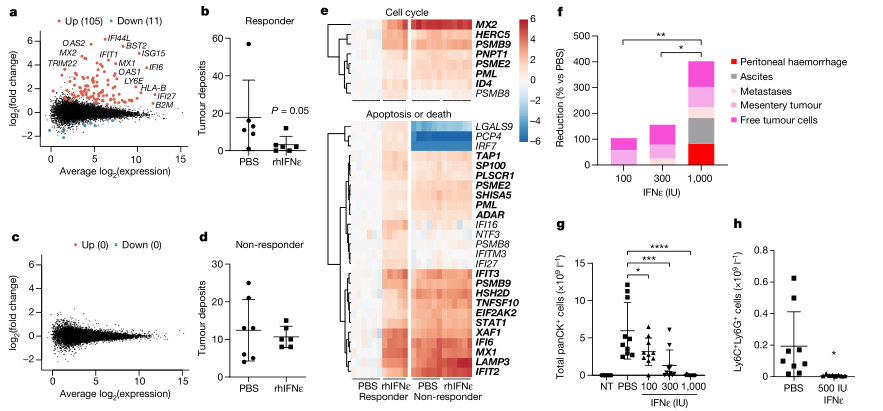
图4. IFNε对晚期卵巢癌HGSOC PDX模型及ID8 TB模型的影响
为了确定激活的抗肿瘤免疫细胞在体内对IFNε反应的有效程度,研究者使用CRISPR-Cas9技术生成了Ifnar1−/−ID8 TB细胞系。然后,使用这种ifnar1缺失的肿瘤细胞系研究重组小鼠IFNε在晚期腹膜转移模型中的活性,其中只有宿主细胞会直接对IFN产生反应。令人惊讶的是,这些Ifnar1−/−ID8 TB肿瘤被清除的效果与Ifnar1野生型(ID8 TB)细胞一样有效,表明IFNε的完全抗肿瘤作用可能是免疫介导的。为了进一步阐明抗肿瘤免疫的机制,研究者分析了野生型ID8 TB或Ifnar1−/−ID8 TB肿瘤小鼠的腹膜免疫细胞,MDSCs再次显著降低至接近零。与非荷瘤小鼠相比,荷瘤小鼠CD45 +免疫细胞中的Ki67表达降低,IFNε处理后Ki67表达得以恢复。同样,在荷瘤小鼠中,CD8 + T细胞上CD25的表达降低,但IFNε显著增加了该激活标记物的表达。相反,上调的PD-1在调节性T(T reg)细胞上的表达被IFNε降低,与之前的结果一致。总之,用IFNε处理野生型ID8 TB或Ifnar1 - / - ID8 TB腹膜肿瘤导致免疫环境建立,在这种环境中,抗肿瘤免疫的负调节因子(MDSCs和T细胞)被强烈抑制,但激活的、增殖的T细胞抗肿瘤免疫标志物被诱导表达,导致疾病负担显著减轻。(见图5)
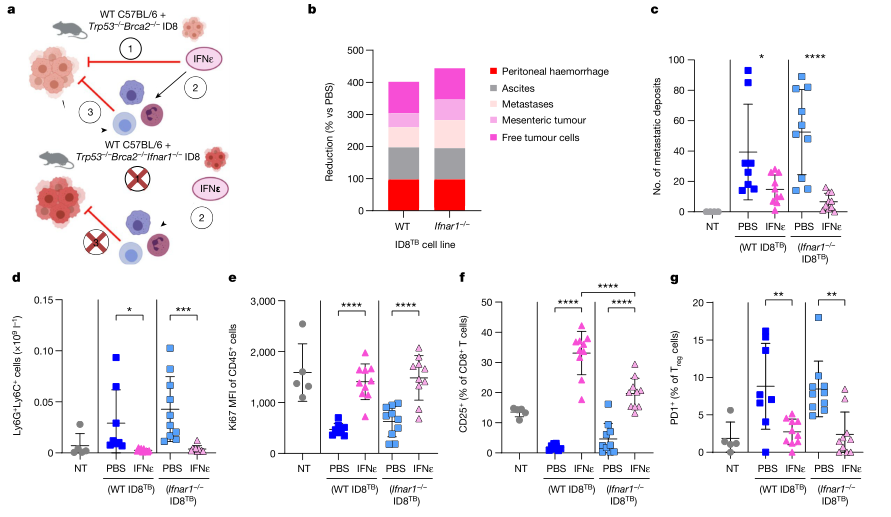
图5. 在ID8 TB晚期卵巢癌模型中,IFNε对IFN反应性和非反应性肿瘤细胞同样有效
综上,IFNε在女性生殖道中是一种固有的肿瘤抑制因子,在HGSOC中,它对免疫细胞有直接作用,还可通过来自肿瘤细胞的因子进行间接免疫调节,表明它用于卵巢癌新的治疗方法中的前景可观。
云克隆开发了与该研究相关的靶标产品,部分指标节选如下:

更多信息,欢迎访问:http://www.cloud-clone.cn/