文献解读 | 纳米颗粒药物递送系统在逆转肝纤维化中的潜力:挑战与策略

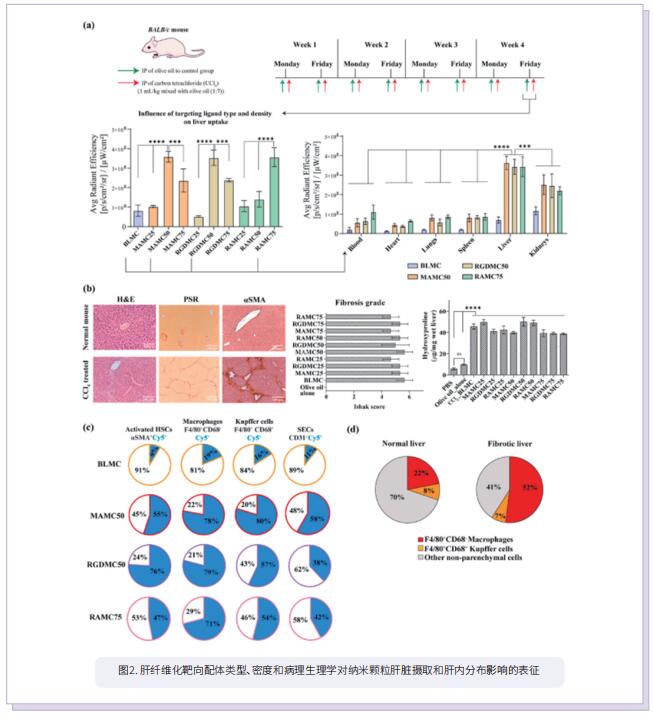
2023年9月6日,澳大利亚昆士兰大学生物工程与纳米技术研究所Kristofer J. Thurecht团队在《Biomaterials》上发表题为“Exploring the impact of severity in hepatic fibrosis disease on the intrahepatic distribution of novel biodegradable nanoparticles targeted towards different disease biomarkers”的文章,系统地研究了靶向策略、纤维化过程中巨噬细胞浸润的程度和纤维化的严重程度对纳米载体的肝脏摄取和肝内分布的影响。

在这篇文章中,云克隆抗体【整合素αM(CD11b)多克隆抗体,PAB685Mu02】受到科研工作者的认可,荣登优秀国际期刊。

肝脏是一个复杂的、功能异质的器官,具有数百种功能,包括解毒、营养代谢和血清蛋白分泌。尽管肝脏在缓解持续损伤和再生方面具有出色的能力,但在慢性损伤期间,其愈合机制受损。在慢性肝病期间,储存视黄醇的肝星状细胞(HSC)的长期激活会导致细胞外基质成分在肝脏中过度沉积。这种动态状态称为肝纤维化。如果不加以控制,肝纤维化可导致门脉高压、肝硬化、肝细胞癌,并最终导致肝功能衰竭。然而,缺乏特异性和药物在靶点的生物利用度不足导致目前尚无抗肝纤维化的临床药物。
基于纳米颗粒的药物递送系统(DDS)在临床前动物模型中显示出逆转肝纤维化的有希望的结果。为了降低脱靶效应的可能性,这些DDS通常配备有特异性配体,靶向在转分化的肌成纤维细胞样活化的肝星状细胞(aHSC)上过表达的受体。然而,这些纳米颗粒制剂都没有过渡到临床使用。这突出表明,需要更好地了解纳米颗粒在这种复杂的疾病环境中所面临的挑战。为此,作者系统地研究了靶向策略、纤维化过程中巨噬细胞浸润的程度和纤维化的严重程度对纳米载体的肝脏摄取和肝内分布的影响。他们开发了一个定义明确的聚合物纳米材料平台,采用了一种新型的可生物降解骨架。接下来,他们选择文献中报道的三种不同的、广泛使用的靶向aHSC的配体类型,根据靶向特异性和积累进行直接评估。当在原代小鼠衍生的aHSC和人HSC(LX-2细胞)上进行测试时,观察到配体类型和配体密度在九种不同纳米粒子制剂的细胞结合方面发挥着重要作用。此外,他们使用流式细胞术对从患有晚期纤维化的四氯化碳小鼠模型中获得的肝脏样本进行了深入分析,证实了寻找最佳配体密度和类型的重要性。这些因素不仅增强了纳米颗粒的靶向效力,而且有助于限制单核吞噬细胞系统(MPS)细胞群的吞噬作用。此外,由于生物屏障的升高,观察到患有终末期肝病的肝脏中纳米颗粒的存在量下降。作者推断纤维化发展的程度会影响纳米颗粒在肝脏中的积累,这突出了需要额外的功能化策略来克服终末期肝病中微环境带来的挑战。
综上所述,作者认为,由于纤维化发展的病理生理性质,浸润的巨噬细胞的非特异性摄取可能无法完全避免,未来的研究应更多地关注于开发一种联合治疗策略,以利用肝纤维化中巨噬细胞对纳米颗粒的增强隔离。