如何降低动脉粥样硬化风险?靶向胆固醇的新方法
动脉粥样硬化(AS)的特征是动脉壁中的脂质积聚、炎症反应、细胞死亡和纤维化,是缺血性心脏病和中风的主要病理基础。AS的主要危险因素包括血浆高水平的低密度脂蛋白(LDL)胆固醇和低水平的高密度脂蛋白(HDL)胆固醇。他汀类药物的干预可以降低血浆LDL胆固醇浓度,从而降低发生冠心病的风险。然而,即使是积极的他汀类药物治疗也不能完全消除心血管风险。因此,迫切需要他汀类药物之外的额外治疗干预措施,以进一步抵抗AS病变,降低患冠心病和中风的风险。近期,多篇文献报道了靶向胆固醇改善AS的研究,可能为心血管疾病的预防和治疗提供帮助。
1. Epsin纳米疗法调节胆固醇转运以加强AS消退
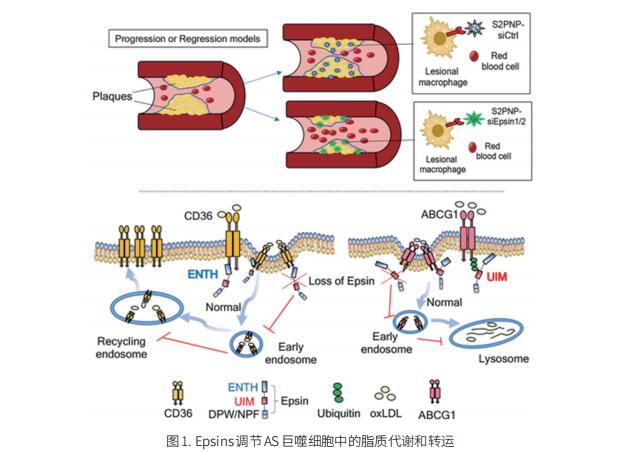
病变巨噬细胞中过量的胆固醇积累引起AS的复杂反应。Epsins是一个高度保守的内吞衔接蛋白家族,促进AS的发展。然而,Epsins在AS进展中的潜在机制和治疗潜力仍然未知。哈佛医学院外科血管生物学项目Hong Chen团队发现Epsins调节AS巨噬细胞中的脂质代谢和转运[1]。通过纳米疗法抑制Epsins可以阻止炎症并加速动脉粥样硬化的消退。利用病变巨噬细胞特异性纳米粒子递送Epsins小干扰RNA,沉默Epsins的表达可减少AS斑块的大小并促进了斑块的消退。机制分析表明,Epsins与CD36结合,通过增强CD36的内吞作用和循环来促进脂质摄取。同时,Epsins通过溶酶体促进ABCG1降解,阻碍ABCG1介导的胆固醇外排和逆向胆固醇运输(图1)。这些研究结果表明,靶向病变巨噬细胞中的Epsins可能通过减少CD36介导的脂质摄取和增加ABCG1介导的胆固醇流出,为晚期AS提供治疗益处。
2. 细胞内tPA-PAI-1相互作用决定肝细胞中VLDL的组装
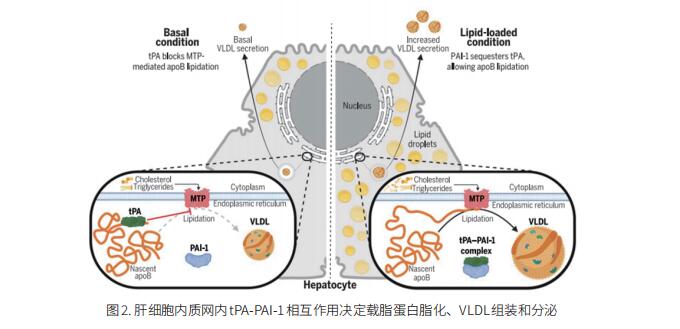
载脂蛋白B(apoB)启动和促进AS相关心血管疾病。血浆组织纤溶酶原激活物(tPA)活性与人类动脉粥样硬化载脂蛋白胆固醇水平呈负相关,但其机制尚不清楚。美国威斯康星医学院医学系Ze Zheng团队发现tPA部分通过其Kringle 2结构域上的赖氨酸结合位点与apoB的N末端结合,阻断apoB与肝细胞中微粒体甘油三酯转移蛋白之间的相互作用,从而降低极低密度脂蛋白(VLDL)组装和血浆apoB脂蛋白胆固醇水平(图2)[2]。纤溶酶原激活物抑制剂1(PAI-1)将tPA从apoB中隔离出来并增加VLDL组装。PAI-1缺乏症患者的VLDL颗粒较小,血浆载脂蛋白胆固醇水平较低。这项研究表明,tPA-PAI-1相互作用决定了肝细胞中VLDL的组装,为脂质摄入的生理反应和肝脏过量载脂蛋白产生的AS相关过程提供了机制见解。
3. 平滑肌α-肌动蛋白错义变体通过调节平滑肌细胞内胆固醇促进AS
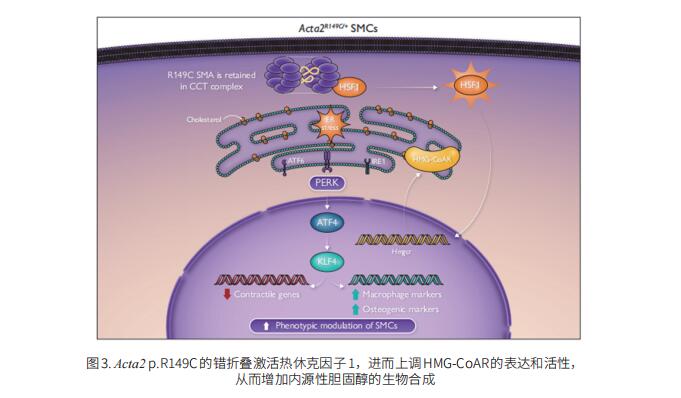
ACTA2,编码平滑肌细胞(SMC)特异性α-肌动蛋白,其p.Arg149Cys变体使无心血管危险因素的个体易患胸主动脉疾病和早发性冠状动脉疾病。美国休斯敦得克萨斯大学健康科学中心麦戈文医学院内科医学遗传学处Dianna M Milewicz团队的研究探讨了这种变体是如何导致AS增加的[3]。与Apoe−/−小鼠相比,高脂血症Acta2R149C/+Apoe−/−鼠的AS斑块负荷增加了2.5倍,血脂水平没有差异。在细胞水平上,R149C α-肌动蛋白的错误折叠激活了热休克因子1,该因子通过增加HMG-CoA还原酶(HMG-CoAR)的表达和活性来增加内源性胆固醇生物合成和细胞内胆固醇水平(图3)。Acta2R149C/+SMC中胆固醇的增加诱导内质网应激,并激活PERK-ATF4-KLF4信号传导,以在缺乏外源性胆固醇的情况下驱动AS相关的表型调节,而WT细胞需要更高水平的外源性胆固醇来驱动表型调节。这些数据确定了平滑肌特异性收缩蛋白中的致病性错义变体易患AS的机制,强调了细胞内胆固醇水平升高在驱动SMC表型调节和AS斑块负荷中的作用。
参考文献
[1]Cui K, Gao X, Wang B, et al. Epsin Nanotherapy Regulates Cholesterol Transport to Fortify Atheroma Regression. Circ Res. 2023;132(1):e22-e42. (IF=20.1)
[2]Dai W, Zhang H, Lund H, et al. Intracellular tPA-PAI-1 interaction determines VLDL assembly in hepatocytes. Science. 2023;381(6661):eadh5207. (IF=56.9)
[3]Kaw K, Chattopadhyay A, Guan P, et al. Smooth muscle α-actin missense variant promotes atherosclerosis through modulation of intracellular cholesterol in smooth muscle cells. Eur Heart J. 2023;44(29):2713-2726. (IF=39.3)
云克隆不仅可提供多种心血管系统疾病模型,包括高血脂及动脉粥样硬化、高血压、心肌肥厚、心肌梗死、心律失常、心力衰竭等,涵盖常见心血管系统疾病。还具有各类心血管系统信号通路常用指标及炎症指标相关产品,可助力广大科研工作者进行心血管系统疾病研究。