急性肺损伤:如何应对肺部炎症,拯救生命?
急性肺损伤(ALI)及其更严重的形式,急性呼吸窘迫综合征(ARDS),是一种危及生命的肺部炎症性疾病综合征,导致肺功能严重受损。ALI的特点是急性发作的呼吸窘迫、水肿形成和严重低氧血症,通常由肺的直接或间接损伤(即感染、创伤、肺炎、失血性休克等)引起。一旦肺部受伤,就会激活促炎途径,促炎细胞因子和其他介质大量分泌。尽管炎症对潜在疾病的解决至关重要,但过度炎症可导致毛细血管损伤,并进一步破坏肺泡毛细血管屏障,导致肺部水肿,肺顺应性降低,最终导致急性呼吸衰竭。虽然ALI治疗已经取得了重大进展,如机械通气、抗生素和皮质类固醇给药,但ALI的年死亡率仍不乐观。近期,多篇文献报道了ALI中炎症相关研究,为开发新的靶点来阻断ALI进展提供帮助。
1. 血小板GPVI在ALI早期中性粒细胞募集、迁移和NETosis中的关键作用
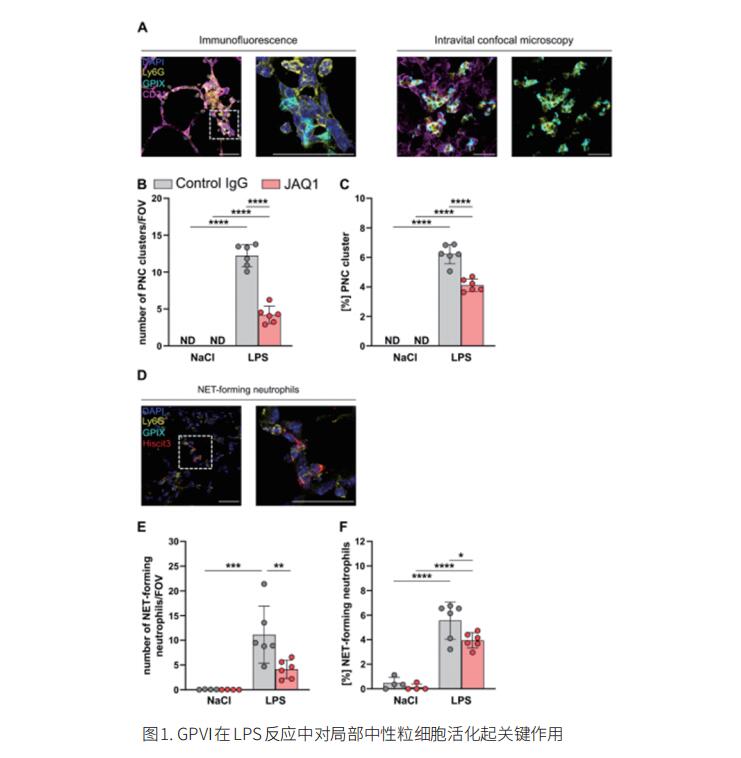
中性粒细胞过度浸润是引起急性炎症和肺损伤的主要原因。血小板参与了ALI/ARDS的发病机制,但其潜在机制尚不完全清楚。德国维尔茨堡大学医院实验生物医学研究所Bernhard Nieswandt团队发现血小板受体糖蛋白(GP)VI在脂多糖(LPS)诱导的小鼠ALI模型中肺血栓炎症早期发挥关键作用[1]。在WT对照小鼠中,鼻内施用LPS会引发严重的肺部和血液中性粒细胞增多症、体温过低和血液乳酸水平升高。相反,GPVI-/-小鼠以及抗GPVI处理的WT小鼠受到显著保护,免受肺部和全身损害,并且没有显示出增加的肺出血。肺切片的分析显示,抗GPVI治疗导致血小板与中性粒细胞的相互作用不太稳定,并且总体上减少了血小板-中性粒细胞复合物(PNC)的形成。抗GPVI治疗还减少了中性粒细胞在内皮细胞上的爬行和粘附,导致中性粒细胞迁移和肺泡浸润减少。在抗GPVI治疗的动物中,中性粒细胞活化减少,并与血小板/中性粒细胞簇和中性粒细胞外陷阱(NETs)的形成显著减少有关(图1)。这些结果证实GPVI是实验性ALI中性粒细胞募集、PNC形成和NETosis的关键介质。因此,抑制GPVI可能是减少引起ALI的急性肺部炎症的一种有前途的策略。
2. 皮肤成纤维细胞的工程化细胞外囊泡在小鼠ALI模型中减轻炎症
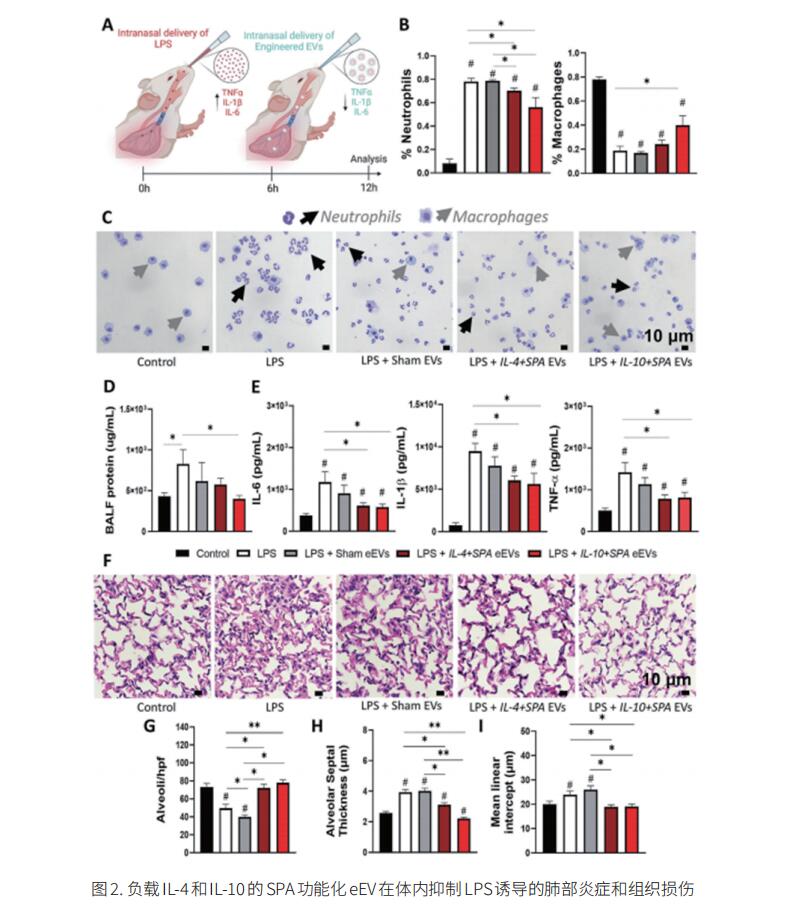
ALI/ARDS患者患有严重难治性低氧血症、肺泡-毛细血管屏障功能障碍、表面活性物质功能受损和炎症通路异常上调。目前,还没有治愈ARDS的方法。美国俄亥俄州立大学生物医学工程系Natalia Higuita-Castro团队构建了基于工程细胞外囊泡(eEV)的纳米载体,用于将抗炎有效载荷靶向递送到炎症/损伤的肺部[2]。结果表明,表面活性剂蛋白A(SPA)功能化的IL-4和IL-10负载eEV在体外和体内均能促进肺内潴留和减少炎症。在eEV治疗后6小时,就观察到组织损伤、促炎细胞因子分泌、巨噬细胞活化、富含蛋白质的液体流入和中性粒细胞浸润肺泡间隙的显著减弱(图2)。此外,代谢组学分析表明,eEV治疗导致炎症肺代谢谱发生显著变化,推动关键抗炎代谢物的分泌。这些结果确定了源自真皮成纤维细胞的eEV通过递送抗炎因子来减少ARDS期间的炎症、组织损伤和损伤的进展的潜力。
3. RUNX1在ALI中促进线粒体自噬并减轻肺部炎症
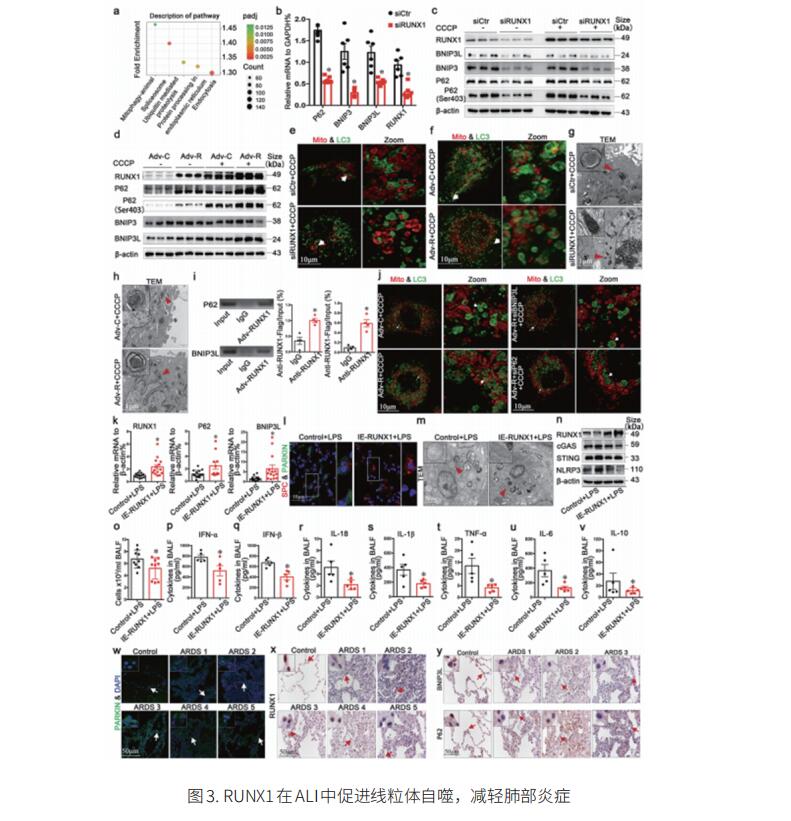
在肺泡上皮细胞中保持线粒体健康对ALI具有巨大的治疗潜力。线粒体自噬是一种旨在维持线粒体健康的细胞过程。因此,全面了解ALI过程中调节肺泡上皮细胞线粒体自噬的因素,可以为ALI治疗方法的发展提供重要信息。四川大学华西医院呼吸系统疾病临床研究中心呼吸与危重症医学科Huajing Wan团队对RUNX1沉默的肺泡上皮细胞(A549)进行了RNA-seq分析,发现参与线粒体自噬途径的基因的表达在RUNX1沉默的A549细胞中受到显著影响[3]。在与线粒体自噬途径相关的差异表达基因中,有6种线粒体自噬衔接蛋白持续减少。RT-qPCR进一步证实了线粒体自噬衔接蛋白表达的变化,显示RUNX1沉默后P62、BNIP3和BNIP3L的mRNA水平显著下调。这些结果表明RUNX1通过上调线粒体自噬衔接蛋白来调节线粒体自噬的激活。对肺泡II型细胞(AT2)中条件表达RUNX1(IE-RUNX1)小鼠进行LPS处理,在肺中观察到RUNX1、P62和BNIP3L的表达增加。LPS诱导的AT2损伤得到缓解。LPS处理后,IE-RUNX1小鼠BALF中炎症细胞数量显著减少,这与促炎细胞因子减少有关(图3)。这些数据支持了AT2中RUNX1依赖性线粒体自噬激活保护肺免受LPS损伤。
参考文献
[1]Burkard P, Schonhart C, Vögtle T, et al. A key role for platelet GPVI in neutrophil recruitment, migration and NETosis in the early stages of acute lung injury [J]. Blood. 2023;blood.2023019940. (IF=20.3)
[2]Salazar-Puerta AI, Rincon-Benavides MA, Cuellar-Gaviria TZ, et al. Engineered Extracellular Vesicles Derived from Dermal Fibroblasts Attenuate Inflammation in a Murine Model of Acute Lung Injury [J]. Adv Mater. 2023;35(28):e2210579. (IF=29.4)
[3]Tang X, Zhong L, Tian X, et al. RUNX1 promotes mitophagy and alleviates pulmonary inflammation during acute lung injury [J]. Signal Transduct Target Ther. 2023;8(1):288. (IF=39.3)
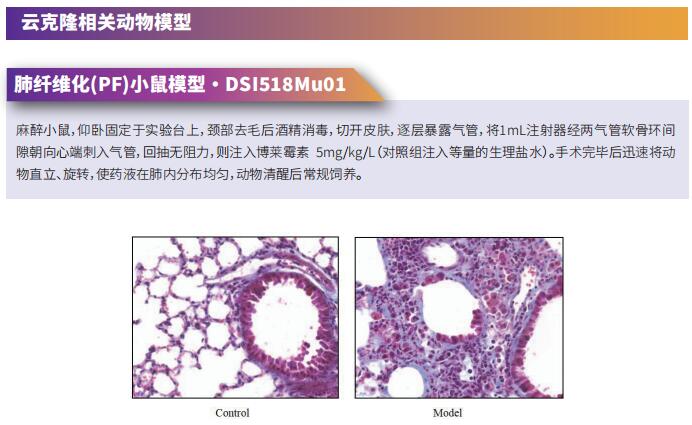
云克隆不仅可提供多种呼吸系统疾病动物模型,包括急性肺损伤、慢性阻塞性肺疾病、哮喘、支气管炎、肺栓塞、肺炎、肺纤维化等,涵盖常见呼吸系统疾病。还具有各类呼吸系统疾病检测指标及上述GPVI、RUNX1、BNIP3等蛋白相关产品,可助力广大科研工作者进行呼吸系统疾病相关研究。