返老还童?不再是梦!——重塑心肌细胞能量代谢方式可实现心脏再生
心脏再生一直以来都是心血管疾病研究领域的重点和前沿。动物出生后,心肌细胞的能量代谢就从糖酵解转变为氧化代谢。与此同时,大多数心肌细胞发生染色质重构和退出细胞周期。这就阻止了心肌细胞分裂,为成人心脏再生形成了一种天然的屏障。近期,德国马克斯·普朗克心肺研究所研究人员在《Nature》上发表了题为“Inhibition of fatty acid oxidation enables heart regeneration in adult mice”的研究探索了代谢重编程在克服心脏再生障碍中的作用。研究发现,阻断脂肪酸氧化能提高心肌细胞对缺氧的抵抗力,刺激心肌细胞增殖,使缺血-再灌注损伤后的心脏再生。
研究人员首先对成年小鼠的心肌细胞(cardiomyocytes,CMs)进行了RNA测序(RNA-seq),数据分析显示,在出生后第一周CMs成熟过程中,糖酵解和细胞周期进展相关的几个关键基因的表达水平降低,而与脂肪酸氧化(FAO)和三羧酸循环(TAC)相关的基因发生了上调。上调的FAO相关基因包括肉毒碱棕榈酰转移酶(Cpt1b)的肌肉特异性亚型,但不包括普遍表达的Cpt1b亚型,而这一普遍表达亚型是线粒体摄取脂肪酸以及随后的FAO所必需的。
为了探索FAO在CMs成熟和增殖中的潜在作用,研究人员构建了Cpt1b敲除(Cpt1bcKO)小鼠模型。观察发现,与对照小鼠相比,Cpt1bcKO小鼠的体重(BW)、心脏重量(HW)、HW/BW比值和心脏形态均未发生变化。然而,由于心肌的同心生长模式,10周龄Cpt1bcKO小鼠的心脏大小、HW和HW/BW比都增加。而且Cpt1bcKO小鼠心脏中CMs的绝对数量增加了一倍。此外,Cpt1bcKO小鼠的CM表面积相对适度增加,这表明心肌同时发生增生性和肥厚性生长。形态学评价显示,最小CMs(<100μm2)群体显著增加,表明Cpt1b失活后会形成新的CMs,中等大小CMs(100~300 μm2)的比例下降,而较大CMs(>300μm2)的数量显著增加,反映了CMs表面积的总体增加。这些数据表明,Cpt1b的缺失会刺激CMs的增殖,而CMs增殖通常在出生一周内在小鼠心脏中终止。
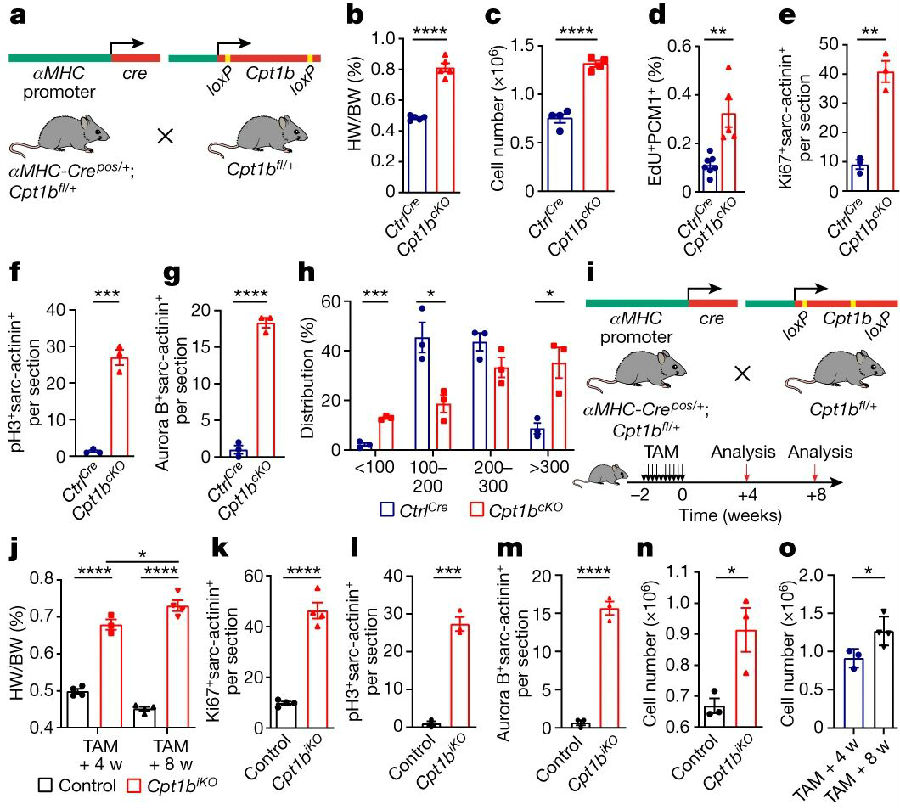
图1. Cpt1b失活诱导CMs增生和肥厚生长
(图片源自《Nature》)
为了研究Cpt1b失活和随后的CMs增殖是否能够促进心脏再生,研究人员对Cpt1bcKO小鼠进行了缺血-再灌注(I–R)损伤模型构建,该模型与人类冠状动脉阻塞患者进行支架重建的情况非常相似。结果发现,与对照动物相比,3周后,Cpt1bcKO小鼠几乎没有I-R诱导的疤痕,尽管在I-R手术后24h两个突变心脏的风险区域(AAR)相似。这表明,阻断FAO获得的增殖潜力允许先前存在的CMs重新进入细胞周期并有助于心脏再生。同时,研究者检测到Cpt1bcKO小鼠在I-R损伤24h后,AAR内梗死面积减少,而在I-R损伤48h后,Cpt1bcKO小鼠心脏收缩变强,这表明抑制FAO也可以保护小鼠免受I-R损伤。组织学分析显示,与对照组相比,Cpt1bcKO小鼠的纤维瘢痕面积明显减少。他们还观察到I-R手术后4周,心脏功能的恢复程度几乎达到了损伤前的水平,这明确地证明了cpt1b失活促进了心脏再生。CM增殖和心脏保护增强有助于减少FAO缺乏小鼠冠状动脉闭塞后的疤痕形成。
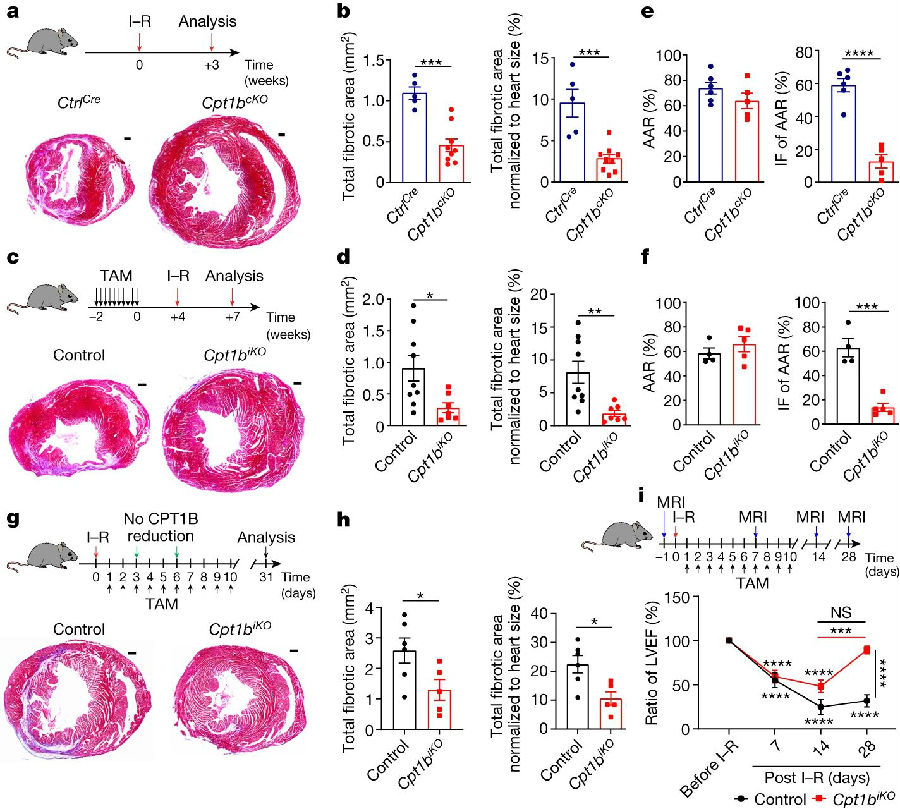
图2. cpt1b介导的FAO阻断可防止I-R损伤并使心脏再生
(图片源自《Nature》)
接下来,作者探究了FAO的阻断如何重新编程CMs代谢。代谢通量和海马实验表明,长链脂肪酸的利用在Cpt1bcKO 的CMs中被有效抑制,没有观察到cpt1无关的中链或短链脂肪酸的明显代偿性使用。此外,靶向代谢组学分析显示,来自中链和长链脂肪酸的酰基肉毒碱水平在Cpt1b缺陷的CMs中显著降低,而细胞内游离肉毒碱水平显著升高。出乎意料的是,细胞内乙酰辅酶A水平和TAC的大多数代谢产物没有显著改变,这表明在缺乏FAO的情况下,CMs会通过不同形式产能量。
随后,作者对另一个潜在的能量来源氨基酸进行了检测。发现与氨基酸转化有关代谢物的显著富集,几种参与TAC的氨基酸中间体表达水平也显著增加。同样,作者发现在Cpt1b缺陷的CMs中,支链氨基酸(BCAA)分解代谢的代谢物水平显著升高。因此,作者推断Cpt1b缺陷的CMs中葡萄糖氧化和BCAA分解代谢的增强有效地补偿了脂肪酸衍生的乙酰辅酶A进入三羧酸循环的代谢通量受损。
值得注意的是,Cpt1b失活后,CMs中α酮戊二酸(αKG)显著增加了近20倍。因为谷氨酰胺和谷氨酸的浓度都没有下降,谷氨酰胺和谷氨酸直接转化为αKG似乎不能解释αKG的积累。相反,他们观察到异柠檬酸水平显著降低,同时催化异柠檬酸转化为αKG的异柠檬酸脱氢酶IDH1、IDH2和IDH3A水平升高。此外,在Cpt1b缺失的CMs中,将αKG脱氢酶复合物转化为琥珀酰辅酶a的关键组分OGDH的酶活性有所降低。说明Cpt1b和αKG积累的失活不影响其他三羧酸循环的蛋白水平。上述结果表明,在阻断FAO后,合成水平的提高和代谢水平的降低协同作用使αKG在CMs中积累。
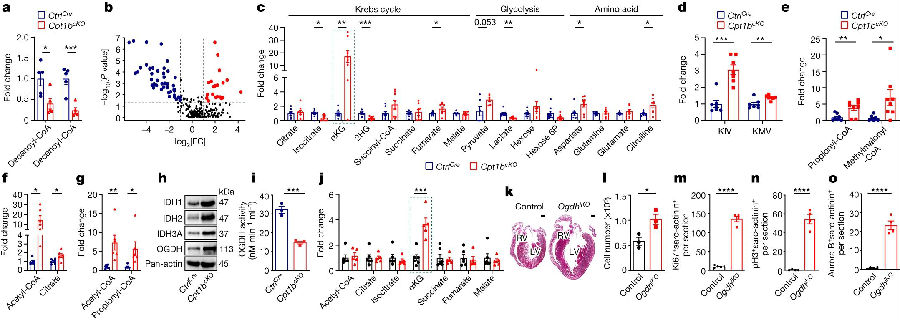
图3. 线粒体脂肪酸输入受阻引起CMs代谢发生改变和αKG水平升高
(图片源自《Nature》)
由于αKG是组蛋白去甲基化酶的重要辅因子。因此,研究人员接着探究了Cpt1b缺陷CMs中αKG的积累是否影响组蛋白甲基化。通过荧光激活细胞分选(FACS)对细胞核进行不同组蛋白赖氨酸甲基化修饰的分析显示,只有H3K4me3水平降低,而其他11种组蛋白赖氨酸甲基化修饰的水平没有降低。而在Cpt1b失活后,异染色质标记物如H3K9me3、H3K27me3和H4K20me2的水平显著增加,这可能是由于CMs向未成熟状态转变带来的次级效应。因此,作者得出结论,αKG增强了H3K4me3特异性去甲基化酶的活性,最终导致H3K4me3水平的降低。
使用FACS分选的CM核对H3K4me3进行染色质免疫沉淀测序(Chip-seq)分析以定位H3K4me3调控变化的基因区域,发现在与CM成熟相关的基因的启动子和基因区域,H3K4me3富集程度普遍降低,而启动子处的H3K9me3和H3K27me3水平保持不变。这些发现表明,αKG的积累激活了H3K4me3特异性去甲基化酶,使其在心脏分化和成熟所需的基因内清除H3K4me3,从而将Cpt1b缺陷型CM向更不成熟的、具有增殖能力的状态进行转变。
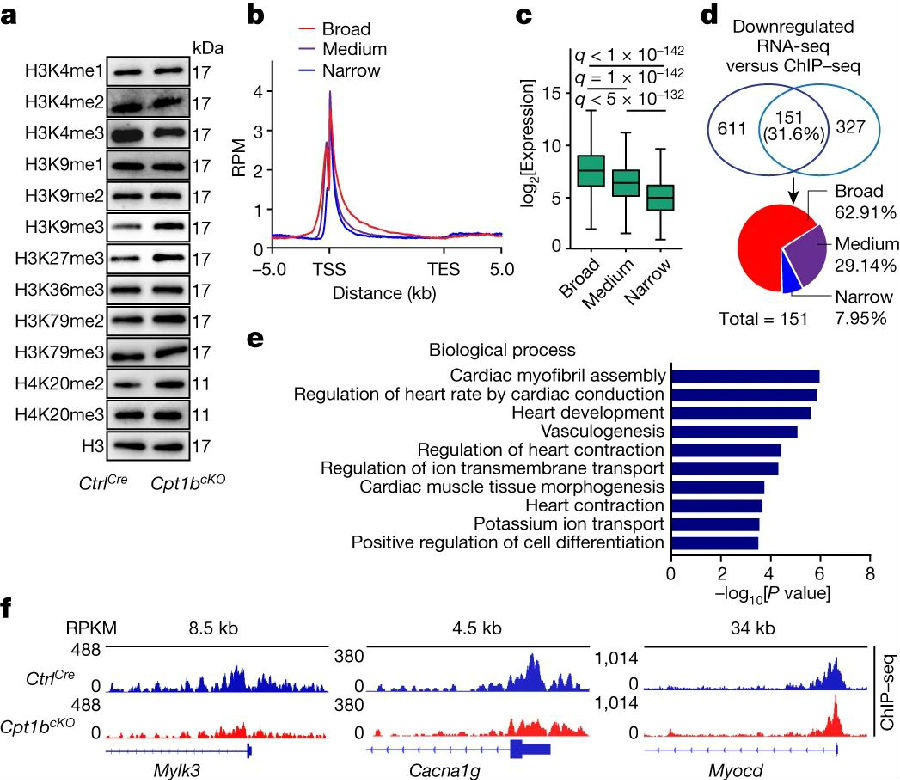
图4. αKG表达量升高诱导H3K4me3去甲基化从而降低CM成熟基因表达水平
(图片源自《Nature》)
为了证实αKG的积累是阻止CM成熟和促进增殖的关键信号,研究人员用细胞渗透性αKG处理P0-1新生小鼠的CMs 4天。观察到在胎儿新生阶段表达的基因水平显著升高,而与CM成熟和分化相关的基因水平降低。另外,用αKG处理也能降低H3K4me3修饰水平,但不影响H3K9和H4K20甲基化。用CPI-455 (αKG依赖性H3K4去甲基化酶KDM5的特异性抑制剂)或细胞渗透性R2HG (αKG29的竞争性抑制剂)治疗新生儿CMs,可阻止αKG诱导的细胞周期活性增强或异柠檬酸脱氢酶Idh3b或Idh3g的过表达。KDM5抑制剂CPI-455对αKG依赖性的药理学抑制表明,αKG对染色质和基因表达的影响是由 KDM5基因家族成员传递的。Kdm5b过表达证实了这一假设,当与αKG联合处理时,Kdm5b可显著降低H3K4me3水平,并显著增加CM细胞周期活性。Kdm5b敲低能有效拮抗αKG的促增殖作用,并能完全恢复αKG处理后降低的H3K4me3水平,从而使与CM成熟相关的几个关键基因的表达量上升。

图5. αKG积累会激活KDM5从而减缓CMs的成熟并促进CMs增殖
(图片源自《Nature》)
总的来说,该研究通过对细胞能量代谢的重编程来重启CMs分裂能力,这一发现具有开创性意义,可能为心肌疾病提供全新的疗法。
云克隆开发了上述研究中相关指标产品以助力科学研究,部分指标如下,供您参考:
<td margin-top:20px;margin-bottom:20px;text-align:center">指标名称
指标名称 | 核心货号 | ||
PKM2 | A588 | PDK4 | A958 |
CPT1B | F369 | ACSS1 | D670 |
ACSS2 | D672 | OGDH | G187 |
Mylk3 | D429 | Acta1 | B634 |
相关动物模型:
货号 | 模型名称 |
DSI504Mu01 | 心肌梗死(MI)/心肌缺血再灌注损伤(IR)小鼠模型 |
DSI504Ra02 | 心肌梗死(MI)/心肌缺血再灌注损伤(IR)大鼠模型 |
DSI529Mu01 | 肾缺血再灌注损伤(RIRI)小鼠模型 |
DSI529Ra01 | 肾缺血再灌注损伤(RIRI)大鼠模型 |
DSI529Gu01 | 肾缺血再灌注损伤(RIRI)豚鼠模型 |
DSI846Ra01 | 视网膜缺血再灌注损伤(RIRI)大鼠模型 |
DSI758Mu01 | 缺血再灌注肺损伤(IRLI)小鼠模型 |
DSI758Ra01 | 缺血再灌注肺损伤(IRLI)大鼠模型 |
DSI758Gu01 | 缺血再灌注肺损伤(IRLI)豚鼠模型 |
DSI529Rb01 | 肾缺血再灌注损伤(RIRI)兔模型 |
DSI529Ca01 | 肾缺血再灌注损伤(RIRI)犬模型 |
DSI847Mu01 | 脊髓缺血再灌注小鼠模型 |
DSI847Ra01 | 脊髓缺血再灌注大鼠模型 |
DSI849Mu01 | 卵巢缺血再灌注小鼠模型 |
DSI849Ra01 | 卵巢缺血再灌注大鼠模型 |