铁死亡与神经退行性疾病的关联
铁死亡是近年来发现的一种新型细胞死亡方式,通常伴随着细胞死亡过程中大量的铁积聚和脂质过氧化。铁死亡的发生是铁依赖性的,铁死亡诱导因子可通过不同途径直接或间接影响谷胱甘肽过氧化物酶(GPX),导致细胞抗氧化能力下降和脂质活性氧积累,最终导致细胞氧化死亡。越来越多的证据支持神经元铁死亡是神经退行性疾病的关键因素。神经退行性疾病和认知障碍中存在铁稳态失调、氧化应激和GPX4抑制等铁死亡发生的主要特征,下文将从这三个方面介绍铁死亡与神经退行性疾病的关联。
Part 1 铁稳态
铁离子对于神经细胞的存活和分化起着重要作用。它是细胞色素、核酸等的重要组成部分,还参与神经递质合成、线粒体呼吸、髓磷脂合成和硫簇蛋白合成等过程,对神经系统正常运行至关重要。而衰老是神经退行性疾病的主要风险因素,伴随着大脑铁的积聚。大量证据表明,许多神经退行性疾病的特征是在中枢神经系统和/或外周神经系统的特定区域积聚铁。阿尔茨海默病(AD)患者严重受损的海马体中的铁水平显著升高。帕金森病(PD)的主要病理生理特征是富含铁的黑质致密部多巴胺能神经元的变性。肌萎缩侧索硬化症(ALS)是一种影响大脑皮层、脊髓和脑干运动神经元的神经退行性疾病。在ALS67的病变区域可以检测到脊髓中大量的铁积聚。因此,铁被认为是促进神经退行性过程的重要因素。
铁稳态由铁调节蛋白(IRPs:IRP1和IRP2)和铁反应元件(IRE)信号通路维持。IRPs可以与未翻译区中含有IRE的RNA干环结合,以操纵靶mRNA的翻译。然而,铁可以与IRPs结合,导致IRPs与IRE分离,并改变靶转录物的翻译。最近在淀粉样蛋白前体蛋白(APP)和α-突触核蛋白(α-Syn)转录物的5'-UTR中发现了IRE。IRPs可以下调α-Syn、APP和淀粉样蛋白β肽(Aβ)的水平以及蛋白质聚集,但在铁积聚的情况下这些蛋白上调表达。研究发现,铁螯合剂可抑制脑组织中IRE调节的APP和α-Syn的表达,对人类神经退行性疾病具有治疗意义。一种广泛使用的铁螯合剂去铁胺(DFO),在动物研究中,可以抑制APP加工和Aβ聚集。而一种口服生物可利用的脑渗透性铁螯合剂去铁酮(DFP),被证明可以减轻神经功能评分并改善铁相关的神经退行性变症状。
Part 2 氧化应激
脑组织因高代谢活性特别容易受到氧化应激的影响。氧化应激增加也是多种神经退行性疾病的共同特征。研究发现,通过使用抗氧化剂可以抑制铁死亡,从而干预并减缓神经退行性疾病病程发展。在三种常用的帕金森病啮齿类动物模型中,一种天然多酚虎杖苷(piceid)能通过选择性调节谷胱甘肽(GSH),丙二醛(MDA)以及超氧化物歧化酶(SOD)等抗氧化因子的水平发挥抗氧化活性并减弱多巴胺能神经退行性变。此外,神经元膜富含易于氧化的多不饱和脂肪酸(PUFA),因此脂质过氧化可能导致与神经退行性变相关的氧化应激。氘化多不饱和脂肪酸(D-PUFA)可有效降低阿尔茨海默病APP/PS1转基因小鼠模型中的脂质过氧化和Aβ水平。α-硫辛酸(ALA)是一种脂溶性和水溶性抗氧化剂,也是一种具有降低脂质过氧化特性的天然酶辅因子,可抑制铁死亡,显著缓解P301S tau转基因小鼠的AD病理症状。在P301S-tau转基因小鼠中,ALA通过减少tau过表达和过度磷酸化诱导的铁积聚、脂质过氧化和上调表达谷胱甘肽过氧化酶4(GPX4),有效抑制认知能力下降(图1)。
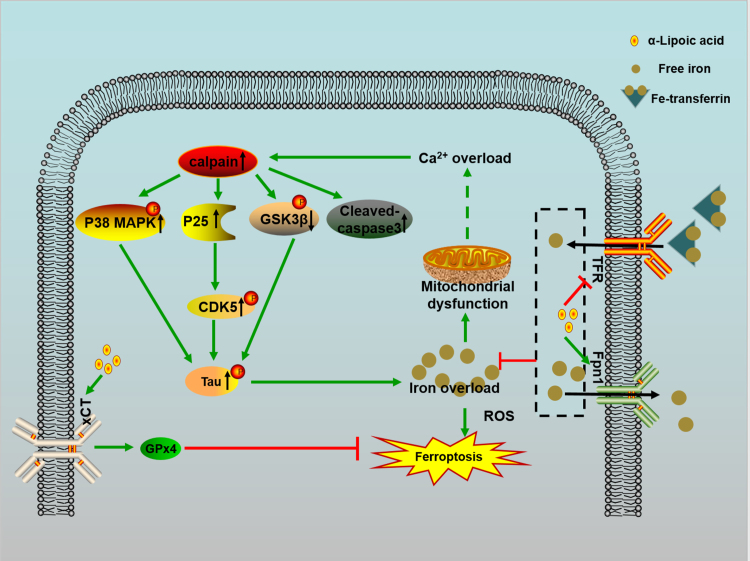
图1. ALA在抑制Tau磷酸化和铁死亡引发的神经元丢失中的作用
(图片来自《Redox Biol.》)
Part 3 铁死亡抑制因子GPX4
铁死亡抑制因子GPX4在神经元铁死亡中发挥着重要作用。GPX4是一种多功能蛋白质,能够减少过氧化的脂质,这种减少膜内脂质过氧化的特性决定了其在抑制铁死亡中的主要作用。
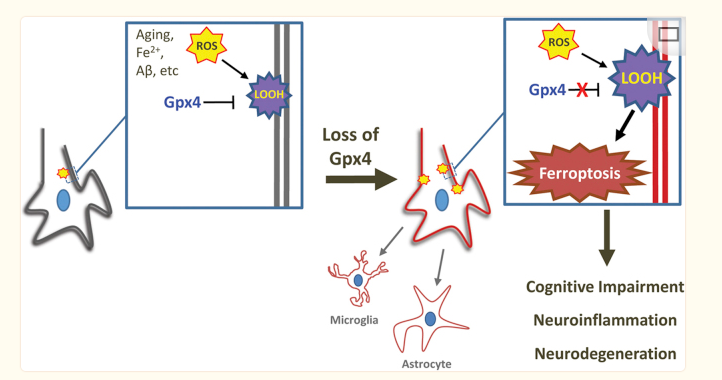
图2. GPX4丢失导致神经退行性变
(图片来自《Redox Biol.》)
2021年,Ruilin Tian, Anthony Abarientos团队发现在氧化应激条件下神经元倾向于发生铁死亡,通过对iPSC分化的人类神经元在正常条件和氧化应激条件进行全基因组筛选,发现铁死亡抑制因子GPX4及GPX4合成通路上的基因是神经元在氧化应激刺激条件下生存所必需的。此外,神经元中GPX4靶向突变会导致小鼠的神经元毒性和神经元快速死亡,并伴有多种铁死亡特征。靶向敲除成年小鼠前脑神经元中GPX4会导致AD样认知障碍和神经退行性变(图2),这些认知障碍和退行性变可被脱铁抑制剂减弱。此外,GPX4的表达可能在PD病理学中发挥神经保护作用。研究表明,GPX4在黑质神经元中的上调,与帕金森脑纹状体营养不良轴突的相关性,表明其可能具有神经保护作用。
硒水平是GPX4活性的关键因素,在AD患者中,硒水平可能与疾病的病理进展有关。硒阻断脂质过氧化产物4-羟基壬烯醛(HNE)诱导的β分泌酶(BACE1)转录,从而减弱Aβ的产生,并保护原代培养的神经元免受aβ介导的毒性影响。在百草枯诱导的大鼠PD模型中,硒喂养也可以减少运动迟缓和DNA损伤。
云克隆可提供上述研究中涉及到的阿尔茨海默病(AD)动物模型以及帕金森病(PD)动物模型。
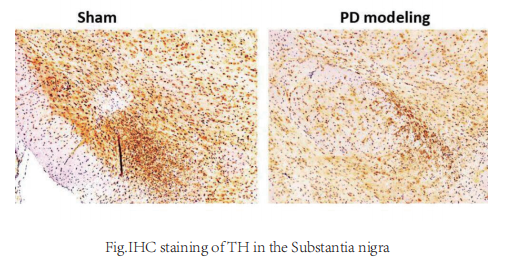
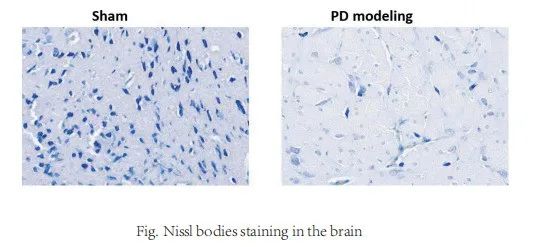
帕金森病(PD)小鼠模型
建模方法:
腹腔注射 MPTP 20mg/kg/d,连续注射14天。对照组使用等体积生理盐水进行腹腔注射,操作及注意事项相同。MPTP 给药结束后,模型建立成功。
药物给以相应的药物处理;正常组、PD模型组使用等体积PBS进行腹腔注射,操作及注意事项相同。
阿尔茨海默病(AD)大鼠模型
建模方法:
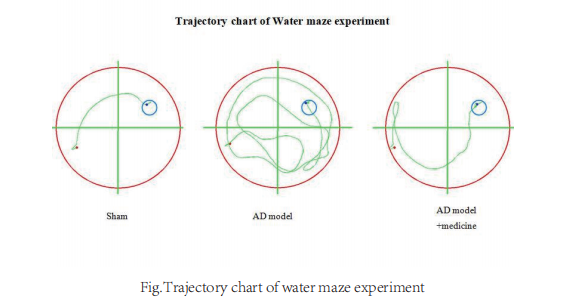
麻醉大鼠,麻醉后继而固定于脑立体定位仪上。按照大鼠脑立体定位图谱,以前囟为零起点,前囟后3.5mm处为穿刺点,中线右侧旁开2mm,而后牙科钻钻开颅骨,采用微量注射器自脑表面垂直进针3mm,即:(AP=-3.5mm, ML=2.0mm, DV=3.0mm),双侧海马CA1区缓慢匀速注射Aβ1-40各10μg(1μL),留针5min,退针后缝合伤口。造模后3d后,开始尾静脉注射,注射生理盐水,大鼠每只给药100μL/次/d,连续给药21天后,进行水迷宫行为学检测。
云克隆还开发了上述研究中涉及到的相关靶标的蛋白、抗体以及试剂盒产品。靶标及核心货号如下,供参考。
指标名 | 核心货号 | 指标名 | 核心货号 | 指标名 | 核心货号 |
GPX4 | C994 | IRP1 | IRP2 | ||
APP | α-Syn | Aβ1-40 | |||
Aβ1-42 | GSH | MDA | |||
SOD | Tau | BACE1 |