Wnt信号通路的前沿研究:突破性发现将如何影响未来的治疗方案?
自1982年发现Wnt家族的第一个成员以来,对Wnt信号传导的研究一直在稳步增加。Wnt信号通路包括非经典通路和经典通路。非经典Wnt途径独立于β-连环蛋白-T细胞因子/淋巴增强因子结合因子(TCF/LEF)。经典的Wnt途径,也称为Wnt/β-连环蛋白途径,涉及β-连环素的核转位和通过TCF/LEF转录因子激活靶基因。经典Wnt通路主要控制细胞增殖,而非经典Wnt途径调节细胞极性和迁移,两个主要通路形成相互调节的网络。Wnt/β-catenin信号通路对于胚胎发育和成人组织稳态再生是必要的。该通路的异常调节与不同的疾病密切相关,这表明Wnt/β-catenin信号通路是一个有吸引力的疾病治疗靶点。
1. Wnt信号通路与肠道干细胞
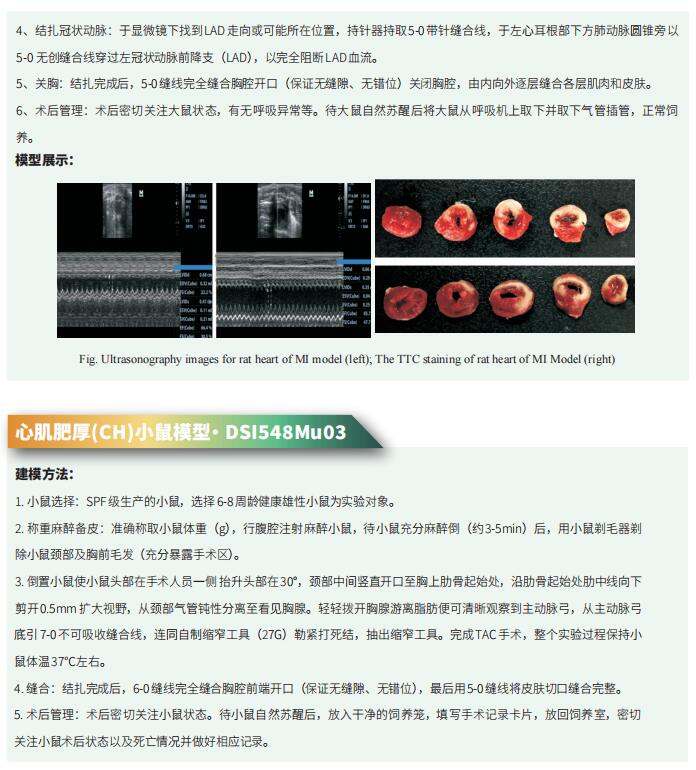
干细胞的再生潜力取决于来自干细胞生态位的微环境线索。在肠道中,上皮和间充质Wnt信号是负责肠干细胞(ISC)功能的分子环境的中心部分。Wnt信号的短暂增加促进损伤后或炎症性肠病中的再生,而该途径的组成性激活导致结直肠癌癌症。美国加利福尼亚大学口腔科学系和颅面生物学项目Ophir D. Klein团队报道了在Wnt信号增加的背景下,Discs larg 1(Dlg1)是ISC生存所必需的蛋白[1]。RNA测序(RNA-seq)和遗传小鼠模型表明,DLG1调节细胞对增加的经典Wnt配体的反应。这是通过Arhgap31的转录调节发生的,Arhgap是一种GTP酶激活蛋白,使CDC42失活,CDC42是非经典Wnt途径的效应子。这些发现揭示了ISC在Wnt依赖性再生过程中所依赖的经典Wnt配体和非经典Wnt途径之间先前未被充分重视的串扰(图1)。
2. Wnt信号通路与肺癌转分化
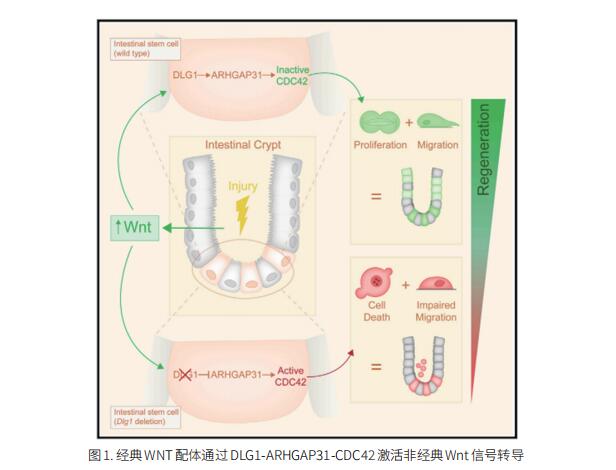
Lkb1缺乏使Kras突变型肺癌具有很强的可塑性和腺向鳞状转分化(AST)的潜力。然而,Lkb1缺乏如何动态调节AST在很大程度上仍是未知的。中国科学院CAS分子细胞科学卓越中心Hongbin Ji团队利用经典AST小鼠模型(KrasLSL-G12D/+;Lkb1flox/flox, KL),通过动态网络生物标志物(DNB)综合分析了肺肿瘤不同阶段的时间转录组动力学,并确定了活性氧(ROS)通过其下游效应物FOXO3A过度积累突然抑制Wnt信号的临界点[2]。使用两种不同的Ctnnb1条件敲除小鼠株对Wnt途径的双向遗传扰动证实了其在AST负调控中的重要作用。在临界点之前而不是之后Wnt通路的药理学激活抑制了鳞状细胞的转分化,突出了AST在越过临界点后的不可逆性。通过对小鼠和人类肿瘤的转录组学比较分析,他们发现腺癌和鳞状细胞癌的谱系特异性转录因子(TF)形成了一个“阴阳”对抗网络。Wnt途径的失活优先抑制腺瘤谱系TF网络,从而破坏“阴阳”稳态,向鳞状谱系倾斜,而NKX2-1(一种腺瘤谱系TF)的异位表达显著抑制了Wnt途径失活加速的表型转变(图2)。这项研究确定了AST的临界点,并强调了ROS-Wnt轴在AST临界点动态协调腺和鳞状细胞特异性TF网络之间的稳态中的重要作用。
3. Wnt信号通路与心脏重塑
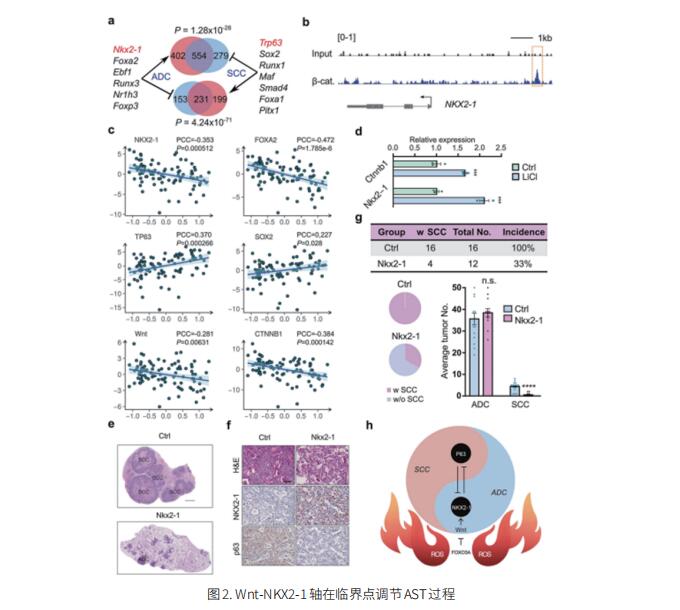
右心室(RV)适应压力增加后负荷的能力决定了肺动脉高压(PAH)患者的生存率。目前,除了心脏/肺移植外,没有任何特定的治疗方法可以预防RV衰竭。德国马克斯·普朗克心肺研究所Soni Savai Pullamsetti团队采用分子、生化和药理学方法,在体外和体内研究Wnt信号在RV重塑中的作用[3]。Wnt/β-catenin信号分子在PAH患者和RV超载动物模型中上调。Wnt/β-catenin信号的激活通过FOSL1和FOSL2的转录激活导致RV重塑。基因抑制β-catenin、FOSL1/2或WNT3A刺激RV成纤维细胞可显著降低胶原合成和其他重塑基因。使用PORCN抑制剂,LGKK-974对Wnt信号进行药理学抑制,可减轻纤维化和心脏肥厚,从而改善肺动脉束带和单罗塔林诱导的RV过载的RV功能(图3)。这项研究强调Wnt信号在RV衰竭中的作用,其抑制可能为RV功能恶化的PAH患者提供一种潜在的治疗策略。
4. Wnt信号通路与脂肪组织发育
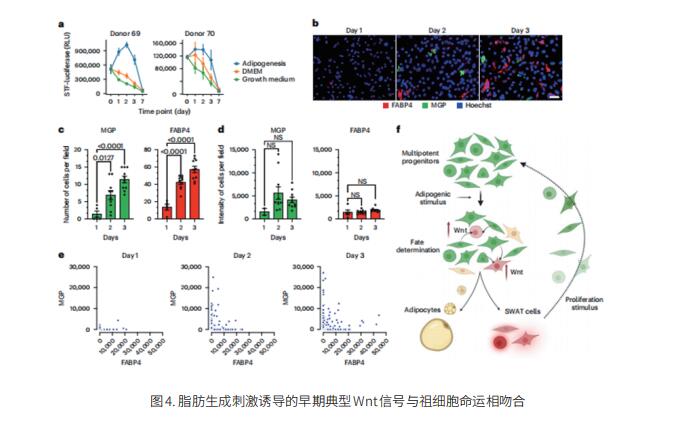
间充质干/祖细胞在整个生命周期中对组织发育和修复至关重要,但它们如何在慢性分化压力下维持尚不清楚。使用人类祖细胞的单细胞转录组学,美国马萨诸塞大学陈氏医学院分子医学项目Silvia Corvera团队发现脂肪分化刺激引发两个细胞轨迹:一个轨迹导致分化的脂肪细胞命运,但另一个轨迹产生了一个细胞库,可以恢复增殖能力和分化为多个谱系的能力[4]。这种多能细胞池通过结构、细胞外基质蛋白基因的表达和Wnt靶基因的表达来表征。功能研究表明,细胞在这两个轨迹中的相对分布是由典型的Wnt信号控制的(图4)。局部Wnt水平可能决定脂肪组织分布的个体变化及其增生或肥大的倾向,其与代谢性疾病风险相关。这项研究发现了一种由Wnt信号驱动的脂肪细胞祖细胞库维持机制,将有助于解析在不同储存和不同生理状态下脂肪组织发育的不同阶段运作的机制。
参考文献
[1]Castillo-Azofeifa D, Wald T, Reyes EA, et al. A DLG1-ARHGAP31-CDC42 axis is essential for the intestinal stem cell response to fluctuating niche Wnt signaling. Cell Stem Cell. 2023;30(2):188-206.e6. (IF=23.9)
[2]Fang Z, Han X, Chen Y, et al. Oxidative stress-triggered Wnt signaling perturbation characterizes the tipping point of lung adeno-to-squamous transdifferentiation. Signal Transduct Target Ther. 2023;8(1):16. (IF=39.3)
[3]Nayakanti SR, Friedrich A, Sarode P, et al. Targeting Wnt-ß-Catenin-FOSL Signaling Ameliorates Right Ventricular Remodeling. Circ Res. 2023;132(11):1468-1485. (IF=20.1)
[4]Yang Loureiro Z, Joyce S, DeSouza T, et al. Wnt signaling preserves progenitor cell multipotency during adipose tissue development. Nat Metab. 2023;5(6):1014-1028. (IF=20.8)
云克隆不仅可提供相关动物疾病模型,例如各类肿瘤实验动物模型、心肌梗死、心力衰竭、糖尿病、非酒精性脂肪肝模型等,还开发了Wnt通路相关指标检测产品,可助力广大科研工作者进行Wnt通路相关研究。