抑郁症:从症状到根源,探索有效的治疗策略让患者重获快乐
抑郁症影响着全球约10%的人口,是导致残疾和自杀的主要原因。抑郁症状的核心特征包括情绪低落,对活动的兴趣或愉悦度下降,注意力不集中,过度内疚或自我价值感低下,食欲和体重变化,失眠或嗜睡,疲劳,认知障碍以及自杀念头。抑郁症是社会、心理和生物因素综合作用的结果。在生活中经历过不良事件(失业、丧亲、创伤事件)的人更容易患抑郁症。抑郁症反过来可以导致更大的压力和功能障碍,影响患者的生活并加剧抑郁症状。目前对确诊抑郁症的患者的治疗重点包括抗抑郁药和心理治疗师。虽然抗抑郁药通常比安慰剂更有效,但一些证据表明,只有大约一半服用抗抑郁药的人达到了临床显著的反应。因此,迫切需要新的、更有效的抑郁症治疗方法。
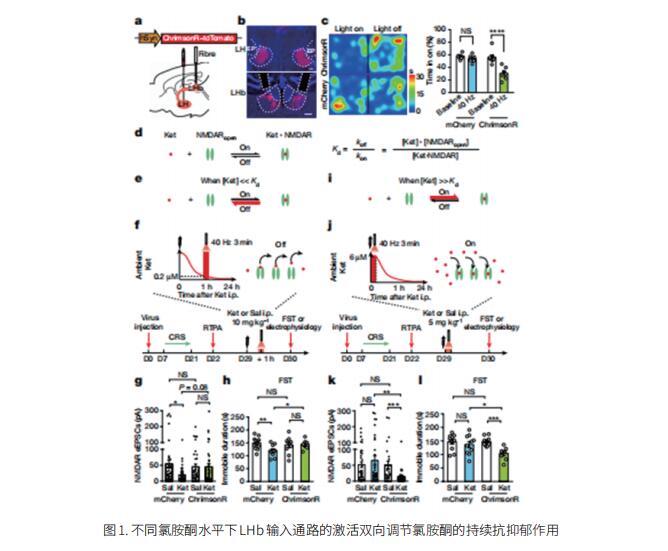
1. 氯胺酮通过外侧缰核中NMDAR捕获发挥持续抗抑郁作用
氯胺酮的两个特点使其成为一种有吸引力的治疗抑郁症的药物,即它的快速起效和持续的活性。与氯胺酮的快速作用相比,其持续抗抑郁作用的机制尚不清楚。浙江大学医学院附属第四医院国际医学院精神科Hailan Hu团队证明了单次全身注射后,氯胺酮继续抑制爆发放电并阻断外侧缰核(LHb)的N-甲基-d-天冬氨酸受体(NMDAR)长达24小时[1]。NMDAR的这种长期抑制不是由于内吞作用,而是取决于氯胺酮在NMDAR中的使用依赖性捕获。通过激活LHb并在不同血浆氯胺酮浓度下打开局部NMDAR,利用氯胺酮与NMDAR相互作用的动态平衡,能够缩短或延长氯胺酮体内的抗抑郁作用(图1)。这些结果为氯胺酮持续抗抑郁作用的因果机制提供了新的见解。基于氯胺酮与NMDAR相互作用的生物物理特性调节氯胺酮作用持续时间的能力为氯胺酮的治疗应用开辟了新的机会。
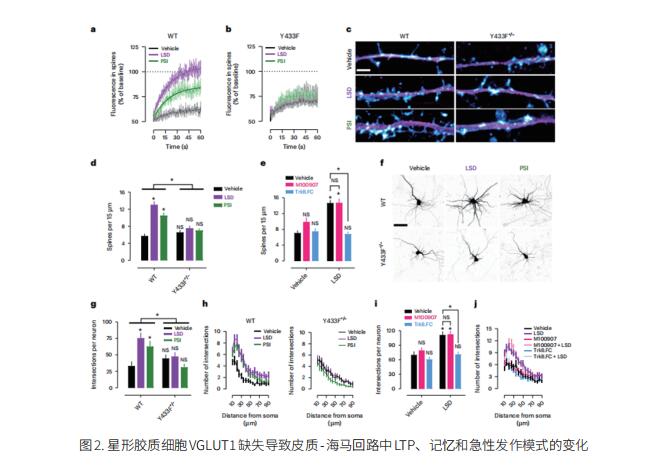
2. 致幻剂通过直接结合BDNF受体TrkB促进可塑性
致幻剂产生快速和持久的抗抑郁作用,并诱导神经可塑性,类似于临床批准的抗抑郁药的作用。芬兰赫尔辛基大学神经科学中心Eero Castrén团队发现致幻剂麦角酸二乙胺(LSD)和脱磷酸裸盖菇素直接与TrkB结合,亲和力比其他抗抑郁药高1000倍,致幻剂和抗抑郁药与TrkB二聚体跨膜区域内不同但部分重叠的位点结合[2]。致幻剂对小鼠神经营养信号、可塑性和抗抑郁样行为的影响依赖于TrkB结合和内源性BDNF信号的促进,但不依赖于5-羟色胺2A受体(5-HT2A)的激活(图2),而LSD诱导的头抽搐依赖于5-HT2A,不依赖于TrkB结合。这些数据证实TrkB是抗抑郁药的一个常见的主要靶点,并且表明缺乏5-HT2A活性的高亲和力TrkB阳性变构调节剂可能保留致幻剂的抗抑郁潜力而不产生致幻作用。
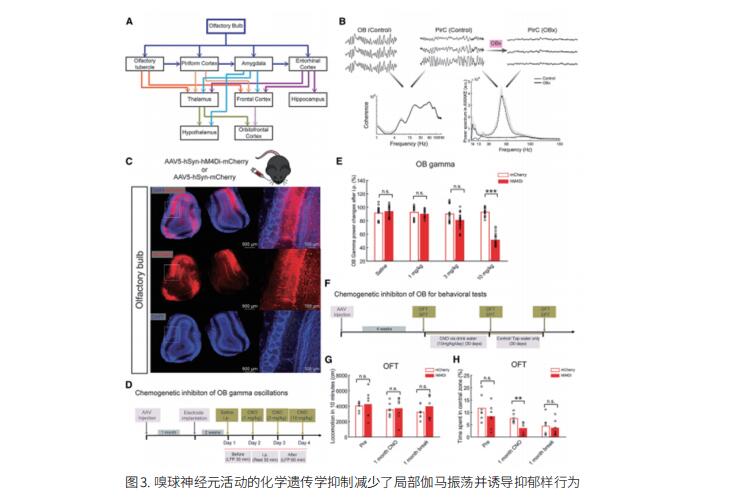
3. 嗅球驱动的伽马振荡减轻了啮齿动物的抑郁样行为缺陷
尽管对重度抑郁症的病因仍知之甚少,但伽马振荡减少是一个新兴的生物标志物。匈牙利塞格德大学生理学系Antal Berényi团队发现嗅球神经元或其梨状皮质输出信号的短暂功能抑制会降低啮齿动物边缘区域的伽马振荡功率,并诱导抑郁样行为(图3)[3]。通过闭环电神经调控增强伽马振荡从嗅球到边缘结构的传输减轻了这些行为。相反,通过反相位闭环刺激沉默伽马传递会增强动物的抑郁样行为。这些诱发的行为被氯胺酮治疗中和,恢复边缘伽马振荡功率。这些研究结果揭示了啮齿类动物边缘区域伽马振荡和抑郁样行为之间的因果关系。干扰这些内源性节律会影响啮齿动物抑郁模型的行为,这提示恢复伽马振荡可能会缓解抑郁症状。
云克隆不仅可以提供多种精神疾病动物模型,包括行为绝望抑郁、慢性应激抑郁、焦虑症、社会失败应激、精神分裂症等,涵盖常见精神疾病研究;还可提供多个物种小胶质细胞、神经元细胞等原代细胞产品和精神疾病相关指标检测产品及上述NMDAR、BDNF、TrkB、5-HT2A等相关产品,可助力广大科研工作者进行精神疾病相关研究。
参考文献
[1]Ma S, Chen M, Jiang Y, et al. Sustained antidepressant effect of ketamine through NMDAR trapping in the LHb [J]. Nature. 2023;622(7984):802-809. (IF=64.8)
[2]Moliner R, Girych M, Brunello CA, et al. Psychedelics promote plasticity by directly binding to BDNF receptor TrkB [J]. Nat Neurosci. 2023;26(6):1032-1041. (IF=25.0)
[3]Li Q, Takeuchi Y, Wang J, et al. Reinstating olfactory bulb-derived limbic gamma oscillations alleviates depression-like behavioral deficits in rodents [J]. Neuron. 2023;111(13):2065-2075.e5. (IF=16.2)