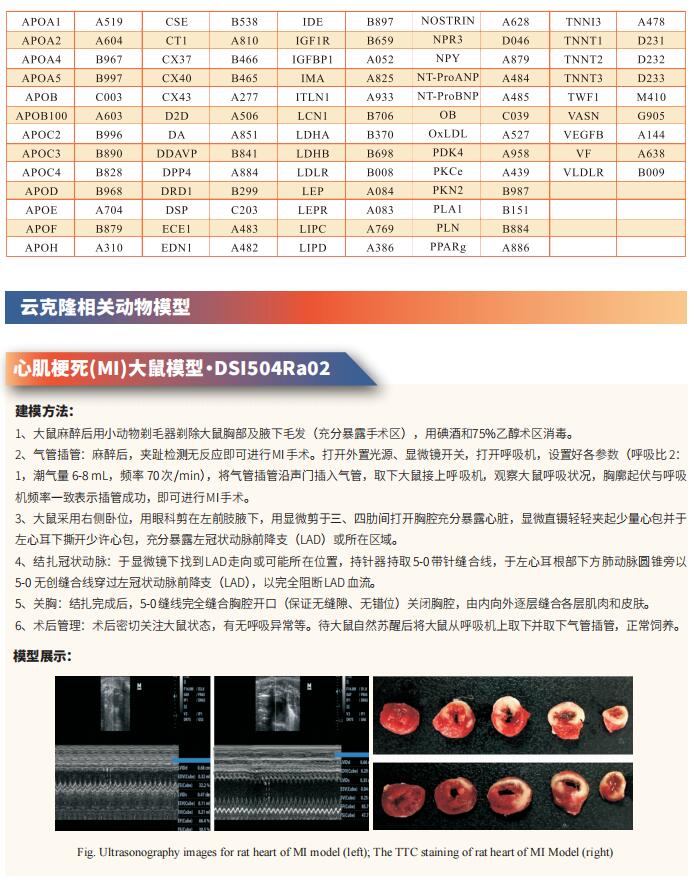
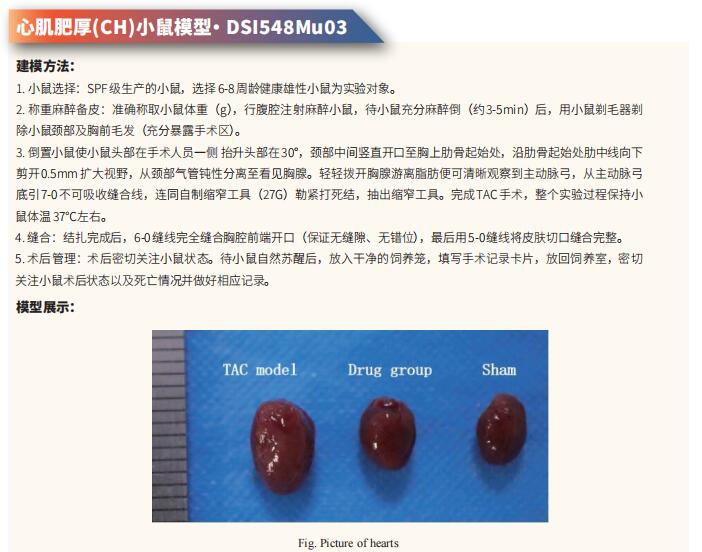
心脏再生的前沿研究:挑战传统观念,重塑受伤心脏的奇迹
几十年来,人们普遍认为成人心脏在受伤后无法再生丢失的心肌。为了应对心脏损伤,包括人类在内的成年哺乳动物用疤痕组织代替坏死的肌肉。心肌细胞的损失最终会损害剩余心肌的收缩能力,导致严重损伤时的心力衰竭和死亡。实现心脏再生或刺激内源性修复机制以恢复损伤后的心脏功能一直是无数研究者的目标。在过去的十年里,科学家们质疑成熟的心脏在受伤后是否真的缺乏创造新心肌的能力,并提出可能存在显著的内源性再生能力。然而,这些结果相互矛盾,临床试验的结果喜忧参半,值得重新审视心脏再生的基础。最近的研究揭示了心脏再生的一些方法和机制,可能为进一步理解心脏组织如何再生并用于临床提供帮助。
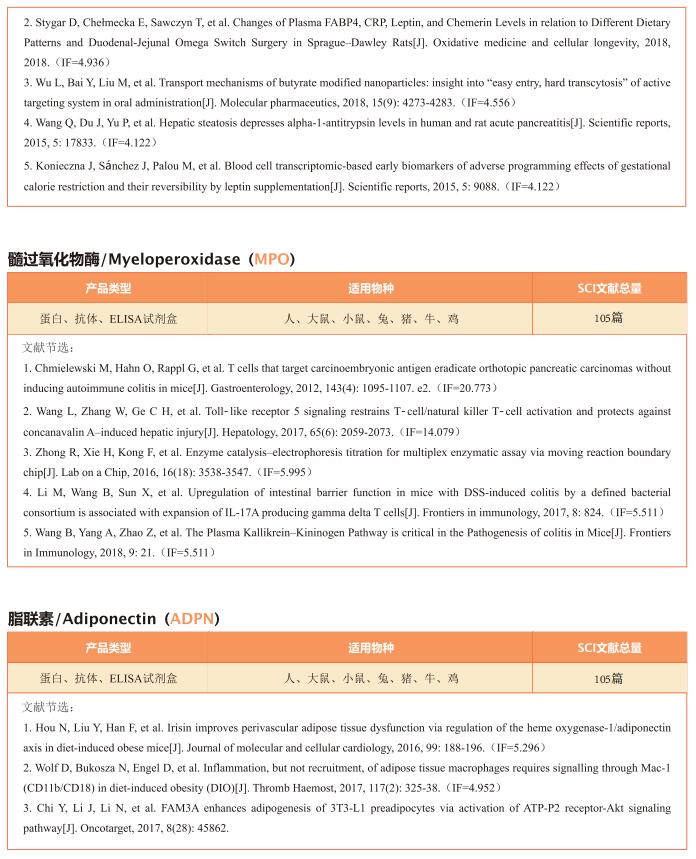
1. 抑制脂肪酸氧化使成年小鼠心脏再生
出生后心肌细胞成熟的特点是从糖酵解到脂肪酸氧化的代谢转换、染色质重构和退出细胞周期,为成人心脏再生设置障碍。为了探索代谢重编程是否可以克服这一障碍并实现心脏再生,德国马克斯·普朗克心肺研究所Thomas Braun团队通过Cpt1b的失活来消除心肌细胞中的脂肪酸氧化[1]。他们发现心肌细胞中脂肪酸氧化的阻断可以提高对缺氧的抵抗力,刺激心肌细胞增殖,使缺血再灌注损伤后的心脏再生。代谢研究揭示了Cpt1b突变心肌细胞能量代谢和α-酮戊二酸积累的深刻变化,导致α-酮戊二酸依赖赖氨酸去甲基化酶KDM5的激活。激活的KDM5使驱动心肌细胞成熟的基因中的广泛H3K4me3结构域去甲基化,降低其转录水平并将心肌细胞转移到不太成熟的状态,从而促进增殖(图1)。这些结果提示代谢成熟塑造了心肌细胞的表观遗传景观,为进一步的细胞分裂创造了障碍,而逆转这个过程可以修复受损的心脏。

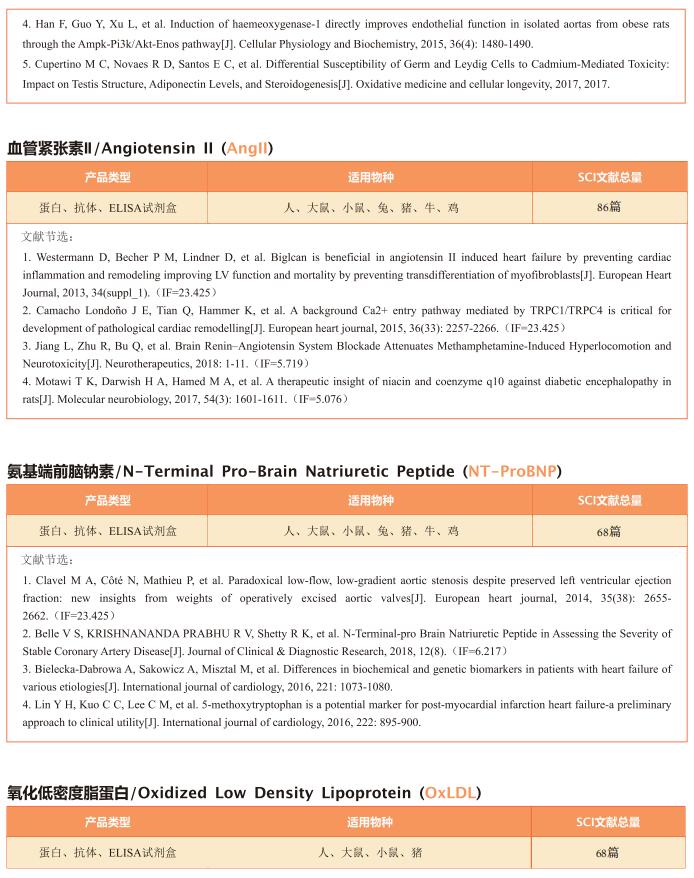
2. 线粒体蛋白翻译减少促进心肌细胞增殖和心脏再生
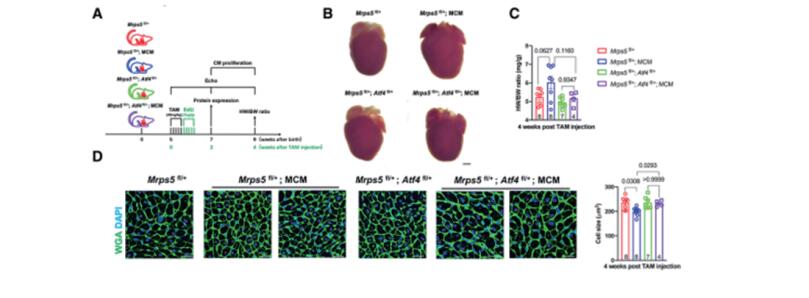
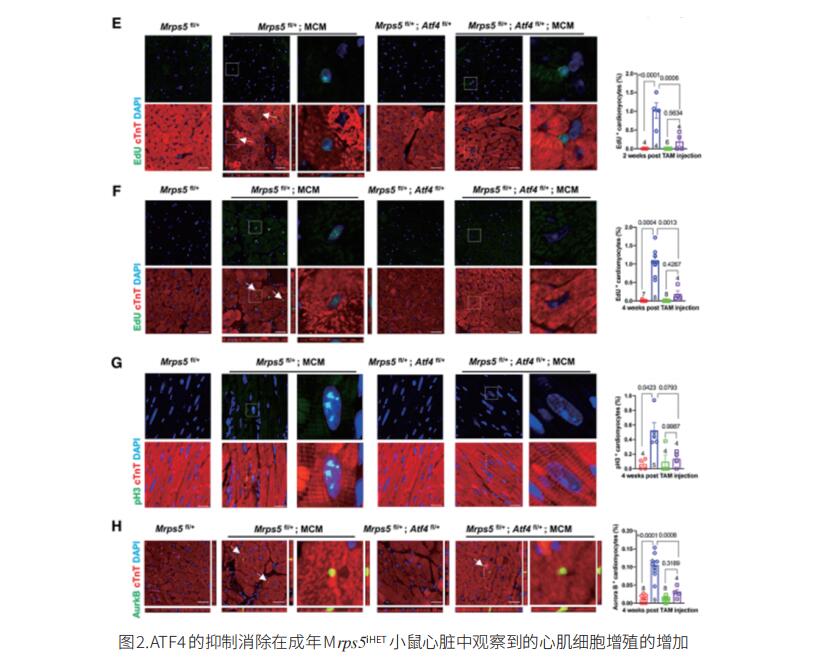
小干扰RNA(siRNA)敲低线粒体核糖体蛋白S5(MRPS5)会抑制线粒体翻译,从而导致线粒体核蛋白失衡。而线粒体代谢的变化与某些形式的心脏病有关。浙江大学医学院转化医学研究所附属第二医院Jinghai Chen团队研究MRPS5缺失的影响以及这些过程对心肌细胞增殖的作用[2]。他们发现小鼠MRPS5单个等位基因的缺失导致心肌细胞增殖和心脏再生增加;这一观察结果与心肌梗死诱导后心功能的改善相关。他们确定转录激活因子4(ATF4)是Mrps5+/-小鼠心肌细胞线粒体应激反应的关键调节因子;此外,ATF4调节动粒支架1(Knl1),导致心肌细胞增殖过程中胞质分裂增加。在Mrps5+/-小鼠中观察到的心肌细胞增殖增加在Atf4的一个等位基因被基因缺失时减弱(Mrps5+/-/Atf4+/-),导致心脏再生能力丧失(图2)。MRPS5抑制激活了一种保守的调节机制,该机制增加了人类诱导的多能干细胞衍生的心肌细胞的增殖。这些数据强调了MRPS5/ATF4在心肌细胞中的关键作用,并为治疗心肌损伤提供了一条新的研究途径。
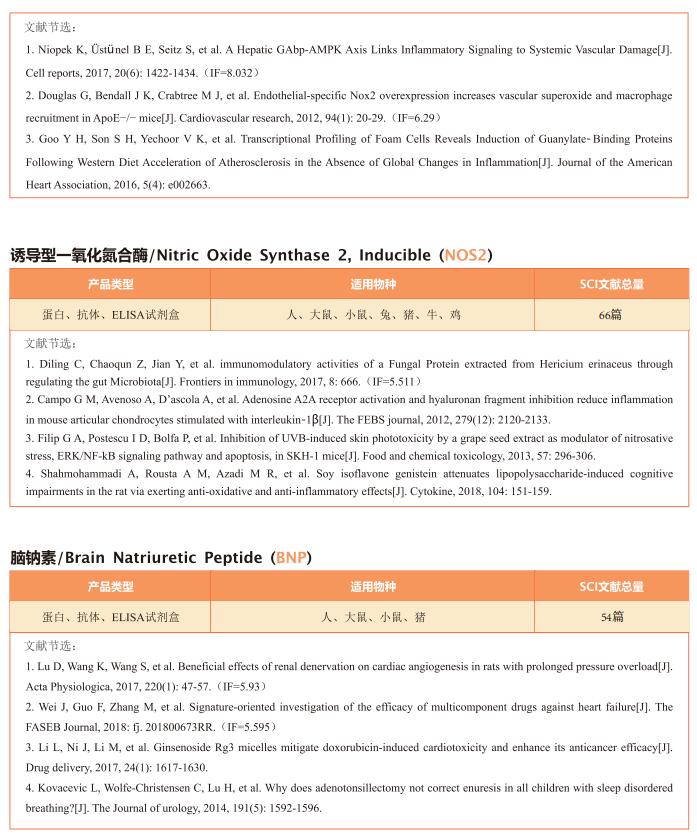
3. 人诱导多能干细胞衍生心肌细胞和内皮细胞联合治疗使梗死心脏再生
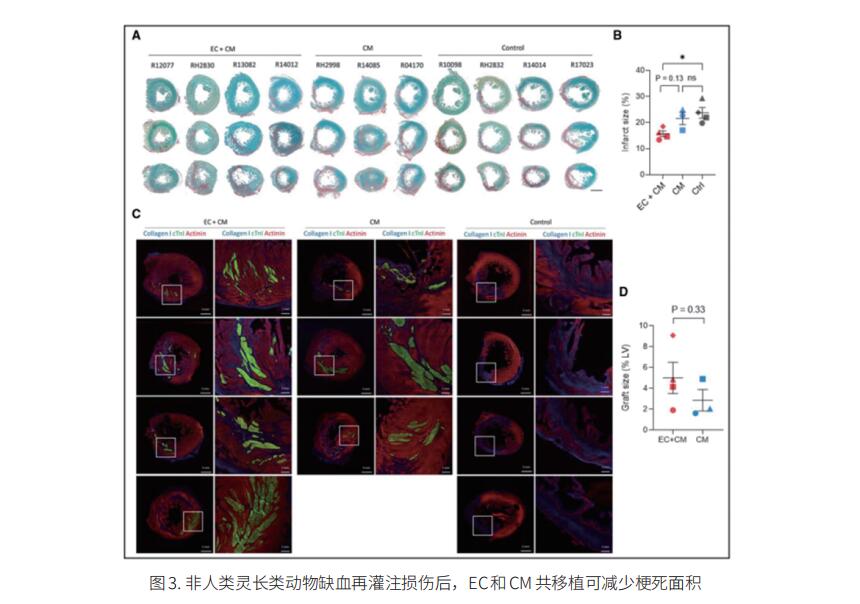
人类诱导多能干细胞(hiPSC)来源的心肌细胞(CM)细胞移植后可以实现哺乳动物心脏的再生。然而,在将其应用于临床实践之前,仍存在一些障碍。仅仅植入CM并不能保证产生功能性组织,因为缺乏氧气和营养供应到目标区域会降低生存能力。台湾中央研究院生物医学研究所Patrick C.H. Hsieh团队研究了hiPSC衍生的内皮细胞(EC)和hiPSC CM共移植对心脏再生的影响[3]。他们发现hiPSC EC在体外和体内促进hiPSC CM的成熟和功能。当与内皮细胞共培养时,CM在细胞结构和功能方面表现出更成熟的表型。在小鼠模型中,联合移植增强了移植物中EC伴随的血管化,促进了梗死区CM的成熟,并改善了心肌梗死后的心功能。此外,在非人类灵长类动物中,EC和CM的移植显著增强了移植物的大小和血管系统,并改善了缺血再灌注后的心脏功能(图3)。这些结果证明了iPSC EC和CM联合治疗心肌梗死后心脏的协同作用,为临床转化提供了一种有前景的策略。
参考文献
[1]Li X, Wu F, Günther S, et al. Inhibition of fatty acid oxidation enables heart regeneration in adult mice [published correction appears in Nature. 2023 Nov;623(7986):E7]. Nature. 2023;622(7983):619-626. (IF=64.8)
[2]Gao F, Liang T, Lu YW, et al. Reduced Mitochondrial Protein Translation Promotes Cardiomyocyte Proliferation and Heart Regeneration. Circulation. 2023;148(23):1887-1906. (IF=37.8)
[3]Cheng YC, Hsieh ML, Lin CJ, et al. Combined Treatment of Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes and Endothelial Cells Regenerate the Infarcted Heart in Mice and Non-Human Primates. Circulation. 2023;148(18):1395-1409. (IF=37.8)
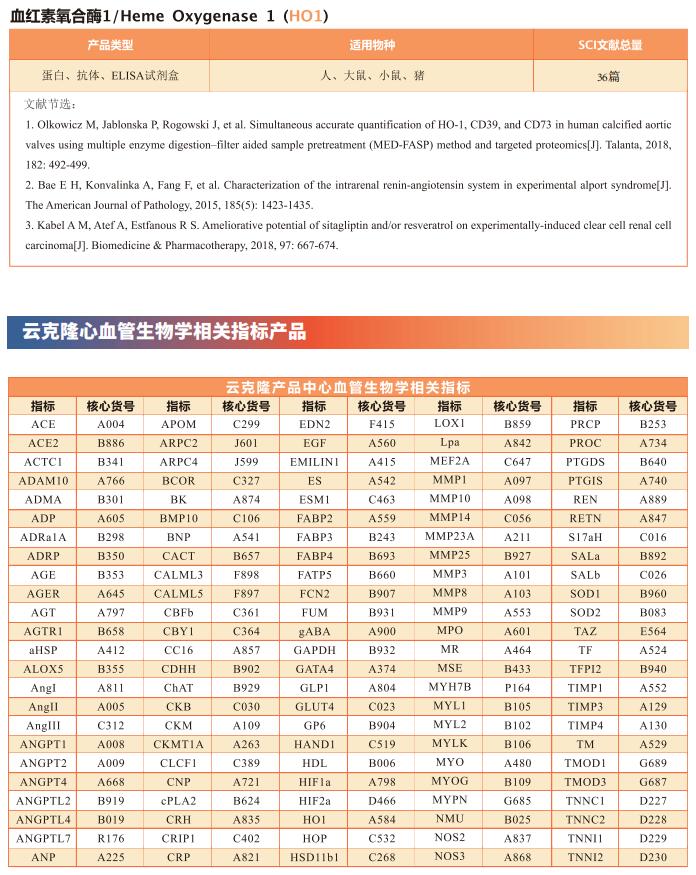
云克隆不仅可提供多种心血管系统疾病模型,包括心肌梗死、心律失常、心肌肥厚、心肌炎、心力衰竭等,涵盖常见心血管系统疾病。还具有多个物种心脏微血管内皮细胞、心肌细胞、心肌成纤维细胞、心包膜成纤维细胞等原代细胞产品和各类心血管系统信号通路常用指标及上述Cpt1b、KDM、ATF4等相关产品,可助力广大科研工作者进行心血管系统疾病研究。