抗衰新发现:IL4-Stat6途径可有效延缓衰老
细胞衰老是一种不可逆的细胞周期停滞的状态,伴随着细胞形态、功能及代谢的改变。细胞衰老可以由多种内外源性因素诱导,如端粒短缩、DNA损伤、表观遗传紊乱、线粒体功能失调等。当衰老细胞的数量在各个器官和组织的数量占比增加时,伴随着衰老相关分泌表型的产生(SASP),释放出更多的促炎症细胞因子,产生慢性炎症的同时改变细胞外基质(ECM)蛋白的机械特性,使组织变硬并降低微环境的粘弹性功能,加速机体的衰老。免疫系统有一套特有的机制来监测衰老细胞并执行清除行动,但是炎症微环境也可导致免疫细胞衰老。近期,北京大学的邱义福团队在《Immunity》期刊发表了题为“Type2 cytokine signaling in macrophages protects from cellular senescence and organismal aging”的文章,揭示IL4-Stat6途径可以保护巨噬细胞免于衰老。
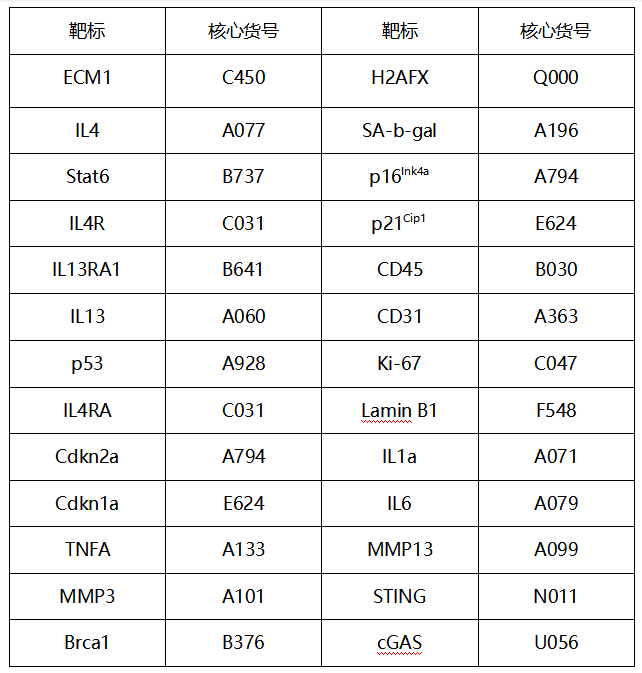
研究人员使用GTEx数据库分析生理衰老过程中的2型细胞因子信号传导。结果显示,在衰老过程中,人类血细胞中IL4R、IL13RA1和Stat6的表达逐渐降低。和年轻小鼠相比,IL13和Stat6在衰老小鼠的多个组织中表达减少,p53在衰老小鼠的表达水平上调。这提示2型细胞因子的传导随着年龄的增长呈下降趋势。为了研究其中的作用机制,研究人员使用了敲除的小鼠模型,和相同年龄的野生型小鼠相比,敲除IL4RA(IL4RA-/-)和Stat6-/-小鼠被毛灰白,光泽度下降。Stat6-/-小鼠骨密度降低,肌肉含量下降,运动表现和活力丧失。在Y迷宫实验中,IL4RA-/-和Stat6-/-小鼠正确选择率较低,均表现出不同程度的空间识别衰退,寿命也比野生型小鼠更短。以上结果显示2型细胞因子信号传导的缺乏导致了与身体和认知相关的衰老样表型。那么,这种衰老加速的具体机制又是什么呢?研究人员对小鼠的肾、肝、肺、肌肉、脾脏等多种组织进行定量研究,发现IL4RA-/-和Stat6-/-小鼠组织中衰老相关指标(Cdkn2a、Cdkn1a)表达水平降低,DNA损伤相关指标(p53、gH2AX)显著上调。免疫组化分析显示,IL4RA-/-和Stat6-/-小鼠肝、肺、肌肉组织中的gH2AX染色评分降低,β-半乳糖苷酶(SA-b-gal)活性更强。同时,研究人员在雄性和雌性小鼠上得到了相似的结果,2型细胞因子信号传导的缺乏加速衰老并没有显示出性别差异(见图1)。
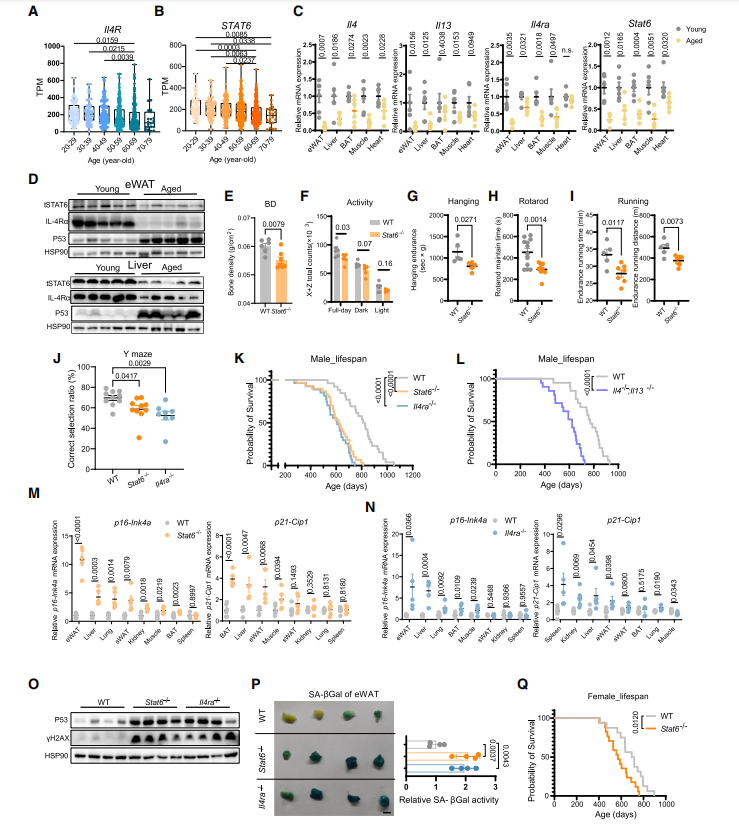
图1 IL-4信号的缺失会损害小鼠的健康和寿命
(图片来源于《Immunity》杂志)
为了了解哪些细胞在失去2型细胞因子信号后会出现衰老,研究人员将小鼠的附睾白色脂肪组织(eWAT)分为两部分,成熟脂肪细胞和基质血管部分(SVF),并对其进行PCR定量分析。p16Ink4a和p19Arf仅在SVF中表达增加,而p21Cip1的表达在这两部分都出现上调。研究人员将SVF包含的细胞分为三类,分别为免疫细胞(CD45+),内皮细胞(CD31+)和其他细胞,并对各部分细胞所占的比例进行分析。他们发现,与野生型小鼠相比,Stat6-/-小鼠的免疫细胞大幅度增加,然而巨噬细胞的占比下降了将近50%。Stat6的基因敲除增加了p16Ink4a阳性免疫细胞和内皮细胞的百分比。研究人员在肺、脾等多个组织的也观察到类似的结果,提示不同组织的微环境并没有减弱p16Ink4a和p19Arf表达的上调,衰老巨噬细胞在不同组织中加速衰老的机制相同(见图2)。体外研究显示,骨髓来源的巨噬细胞(BMDMs)Stat6蛋白磷酸化水平极低,这可能是由于BMDMs自分泌或旁分泌的IL4导致的。巨噬细胞敲除Stat6基因后的变化如下:1. 衰老标志物和SASP指标的表达水平显著增加;2. Ki-67染色结果显示,Stat6-/-巨噬细胞增殖能力受到极大抑制;3. p53和p16表达水平大幅增加,层粘连蛋白B1(laminB1)表达水平下调;4. SA-b-gal+巨噬细胞比例增加;5. Stat6-/-巨噬细胞吞噬能力降低。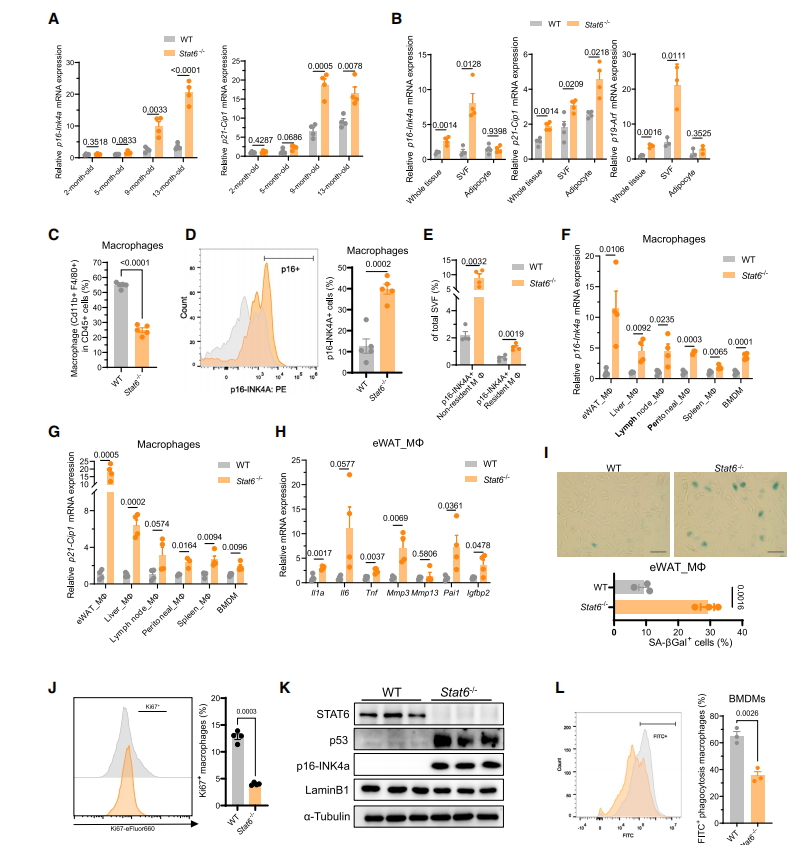
图2 衰老巨噬细胞在Stat6缺陷小鼠中积聚
(图片来源于《Immunity》杂志)
为了观察巨噬细胞缺失Stat6基因对小鼠的影响,研究人员通过一系列实验制备了巨噬细胞特异性缺失Stat6基因的(Stat6flox/flox)小鼠。经过观察发现,和全身缺失Stat6基因的小鼠一样,Stat6flox/flox小鼠运动功能和工作记忆下降,骨密度降低(见图3)。另外,p16Ink4a、p21Cip1、IL1a、IL6、TNFA、MMP3、MMP13等衰老标志物在肝脏中表达水平较高。当研究人员使用氯膦酸脂质体特异性耗竭巨噬细胞时,Stat6特异性敲除诱导的衰老标志物的表达上调消失。使用雷帕霉素治疗后Stat6flox/flox小鼠运动功能恢复,炎症因子水平降低,器官衰老的趋势减轻。以上数据证实,Stat6敲除巨噬细胞促进组织衰老,并对衰老相关的认知和生理功能障碍有促进作用。
图3巨噬细胞中Stat6的缺失诱导小鼠衰老
(图片来源于《Immunity》杂志)
研究人员对Stat6缺失的BMDMs细胞进行转录组分析时,发现455个下调基因和417个上调基因。通路富集分析结果显示,细胞周期和DNA修复途径下调,而免疫反应和炎症信号途径表达高度上调。RNA测序数据表明,Stat6敲除的BMDMs细胞中SASP显著增加。同时研究人员还观察到一系列DNA修复基因的表达下调,这会导致DNA损伤无法及时修复而产生累积,进而促进衰老。体内实验时也在eWAT的巨噬细胞中观察到这种表达下调。由于涉及多种DNA修复途径,研究人员重新分析六种主要途径的基因表达,发现下调的基因主要富集在同源重组(Homologous Recombination)和范科尼贫血(Fanconi Anemia)途径。研究人员对Brca1和Ube2t这两个基因进行重点关注。免疫印迹分析显示,Brca1和Ube2t蛋白的表达水平在Stat6敲除的BMDMs细胞上明显下调。使用顺铂和依托泊苷等DNA损伤诱导剂进行实验发现,敲除Stat6基因的BMDMs细胞对药物敏感性增加。DNA片段未经修复释放到细胞质后,可以激活cGAS-STING途径,促进细胞衰老和炎症反应。使用STING激动剂激活cGAS-STING通路,促进巨噬细胞衰老。添加抑制剂后,Stat6缺失的BMDMs细胞的衰老特征减弱。这些数据表明STAT6缺乏诱导的DNA激活cGAS-STING途径,促进巨噬细胞衰老(见图4)。研究人员在Stat6-/--BMDMs细胞上诱导Stat6过表达,发现DNA修复基因在转录和蛋白表达水平上均有所恢复。Stat6过表达增强了野生型巨噬细胞的DNA修复能力。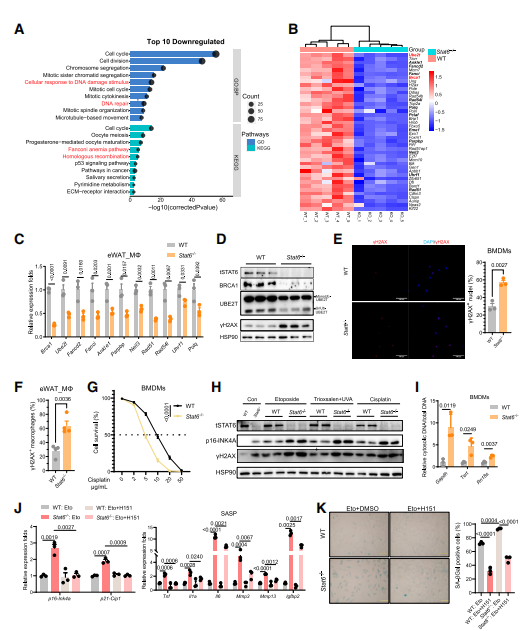
图4 Stat6的缺失损害巨噬细胞的DNA修复
(图片来源于《Immunity》杂志)
接下来,研究人员选取人THP-1巨噬细胞和U937细胞进行体外实验,发现人IL4可以诱导BRCA1和UBE2T的表达上调,而这种诱导可被Stat6抑制剂终止。为了明确IL4治疗是否能够增强巨噬细胞中DNA的修复能力,研究人员使用依托泊苷处理细胞,添加IL4的巨噬细胞细胞DNA修复基因的表达显著上调,使得细胞对依托泊苷所致的DNA损伤抗性增强,同时减少了细胞核DNA的释放(见图5)。动物实验表明,老年野生型小鼠在使用IL4治疗2个月后运动和记忆功能改善,SA-b-gal活性降低、衰老标志物表达下调;但IL4并未改善Stat6-/-小鼠的组织和器官衰老。以上数据表明IL4对小鼠衰老的改善依赖于Stat6途径。
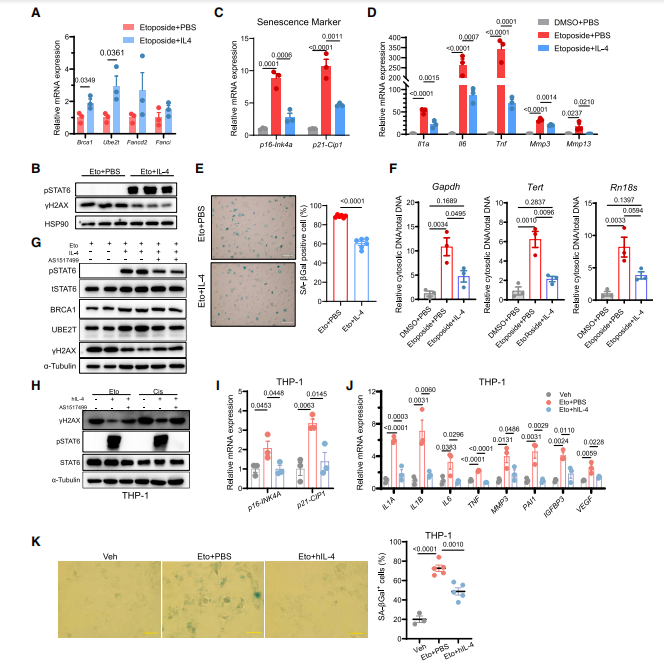
图5 IL4治疗保护巨噬细胞免受DNA损伤
云克隆公司为具有自主研发能力的生物科技公司,助力抗衰老研究,为广大科研人员提供相关检测试剂产品: