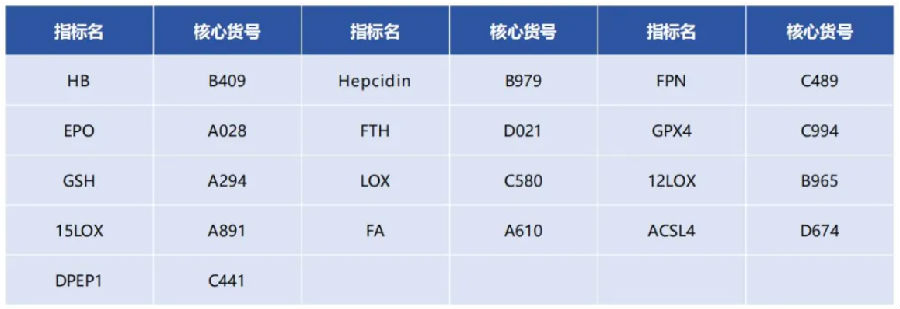
铁死亡与肾脏疾病的关联
肾脏是人体不可缺少的器官之一,是血液的净化器。肾脏过滤血液需要消耗大量能量,而产生能量的过程会消耗大量氧气,这使肾脏细胞面临着极大的氧化应激风险。研究发现,氧化应激失衡是慢性肾病(Chronic Kidney Disease,CKD)的特征之一,同时氧化应激失衡也发生在急性肾损伤(Acute Kidney Injury,AKI)中,并可触发铁死亡。铁死亡会释放损伤因子,加剧肾损伤和肾脏疾病的进展。本文通过铁死亡中的重要代谢途径(图1)探讨铁死亡与肾脏疾病的关联。
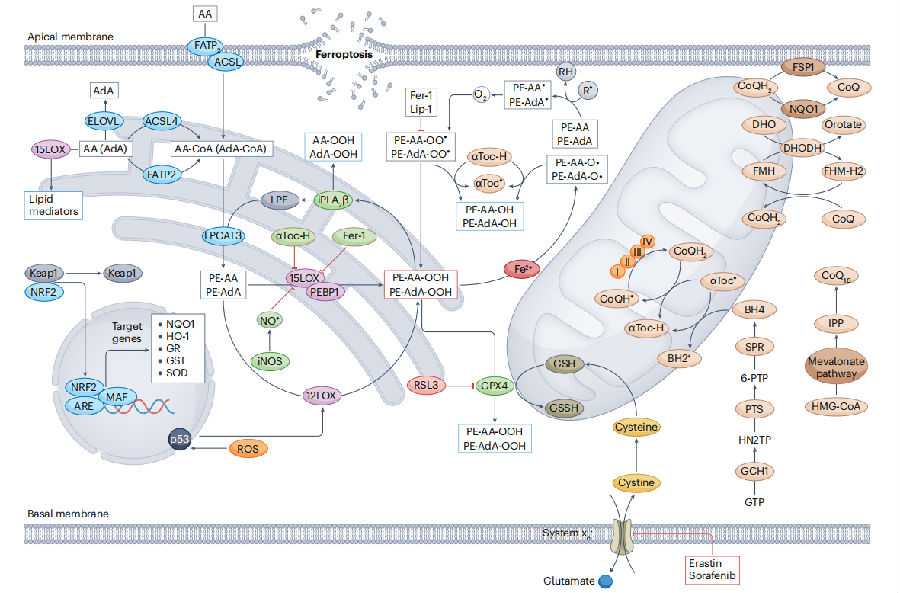
图1. 主要通路代谢网络以及铁死亡的调控
(图片来至《Nature Reviews Nephropathy》)
铁代谢
铁代谢与肾脏疾病之间存在密切的关系。铁是人体内不可或缺的重要元素,参与血红蛋白(HB)的合成、氧气的运输以及多种酶的活性维持等生理过程。当人体铁缺乏时,不仅会影响红细胞的生成和功能,导致贫血等症状,还可能影响肾脏的正常功能。肾功能受损会影响全身的铁平衡,特别是在肾小管疾病中。在Fanconi综合征的患者中,肾小管功能障碍干扰铁的重吸收,导致尿铁排泄增加,加剧肾脏疾病的发展。
铁过载时,当体内铁含量超过转铁蛋白的结合能力时,会导致非转铁蛋白结合铁(NTBI)水平上升。NTBI可能通过多种机制对机体产生危害,包括但不限于促进氧化应激、损伤细胞结构和功能等。另外,NTBI水平增加时,肾病范围的蛋白丢失减少了铁的正常运输途径,同时铁过载增加了体内游离铁的量。这些因素共同作用,使得尿中铁的水平显著增加,加剧肾脏损伤。
铁调素(Hepcidin)在铁代谢中起到关键调控作用。在炎症或微炎症状态下,Hepcidin的水平会升高,它通过与膜铁转运蛋白(FPN)结合,导致这些转运蛋白降解,从而阻止铁从储存部位释放进入血液循环。在CKD患者中,高水平的Hepcidin会使得大量铁被留在细胞内,无法为红细胞生成和其他生理过程所利用,导致功能性铁缺乏。这促使铁稳态失衡,并加剧了CKD患者的贫血状况,导致红细胞生成素(EPO)抵抗,影响其整体健康。而在AKI的情况下,Hepcidin可能具有保护作用。通过质谱法或ELISA法测定尿Hepcidin的临床研究表明,体外循环后尿Hepcidin水平升高与AKI发生率降低相关。与这一发现一致,Hepcidin缺陷小鼠在对缺血再灌注(RIRI)损伤做出反应时发生更严重的AKI,而Hepcidin预处理可减轻RIRI后或对HB诱导的AKI做出反应时小鼠的肾损伤。其保护机制尚不清楚,可能包括FPN的下调、铁的滞留或重肽铁蛋白(FTH)的增加。
PUFA-脂质过氧化作用
多不饱和脂肪酸(PUFA)作为脂质的一种,对肾脏健康尤其有益。例如,omega-3已被证实能够改善缺血诱导的AKI后的肾小管功能。这可能与其抗炎、抗氧化的特性有关,有助于减轻肾脏的炎症反应和氧化应激损伤。
然而肾脏中脂质的过度积累也是有害的。肾脏是脂质代谢和排泄的重要器官。肾脏细胞对脂质代谢的紊乱特别敏感,脂质凋亡引发的细胞死亡、因缺乏谷胱甘肽过氧化酶4(GPX4)和谷胱甘肽(GSH)促使含PUFA的磷脂过度过氧化导致的氧化还原失衡和铁死亡已被确定为AKI、CKD和肾小球肾炎(Glomerulonephritis)的常见细胞死亡机制。透析开始时从患者尿液中提取的肾小管上皮细胞中检测到氧化磷脂酰乙醇胺,表明了铁死亡的发生。有趣的是,抑制铁死亡可改善近端肾小管可塑性和减少炎症来促进肾修复。
在肾脏中,磷脂过氧化是一个复杂的生物化学过程,其中脂氧合酶(LOX)和细胞色素P450还原酶等酶类起着关键作用。在肾毒性血清诱导的肾炎大鼠模型中,LOX(尤其是12LOX和15LOX)及其产物的广泛表达与肾小球中的活性显著增加有关。这表明LOX在肾脏炎症和损伤过程中起着重要作用。此外,LOX和细胞色素P450的产物,如15-羟基二十碳四烯酸(15-HETE)和20-羟基二十碳四烯酸(20-HETE),在慢性肾病(CKD)进展中具有预测价值。这些产物的升高可能反映了肾脏内部磷脂过氧化和炎症反应的严重程度。
另外,在RIRI和叶酸(FA)诱导的AKI模型中,长链脂酰辅酶A合成酶4(ACSL4)被证明在诱导铁死亡中起关键作用。ACSL4能够促进脂质合成和铁死亡的发生,从而加剧肾脏损伤。
硫醇代谢
硫醇代谢的改变和铁死亡在肾脏疾病中的重要作用已被多项研究所证实。硫醇,特别是GSH,是细胞内的重要抗氧化剂,对于维持细胞稳态至关重要。当GSH分解代谢发生改变时,细胞的抗氧化能力可能会受到削弱,尤其是在面对各种病理性应激源的情况下。这些应激源可能包括RIRI损伤、药物毒性、感染等,它们都会增加肾脏细胞的氧化应激压力。在抗氧化机制受损的情况下,肾脏细胞可能更容易受到损伤,从而加速肾脏疾病的进展。二肽酶1(DPEP1)表达增加可能通过加速GSH耗竭或影响细胞内铁稳态来促进铁死亡,从而参与AKI的发生发展。GPX4在细胞抵抗铁死亡过程中起着关键作用。GPX4是细胞内抵抗氧化应激的重要酶之一,特别是能够还原脂质过氧化物,从而防止细胞膜受到氧化损伤。因此,抑制GPX4活性可以有效地诱导肾脏铁死亡。有趣的是,在成年小鼠中,GPX4的全面缺失导致的死亡,直接原因是肾功能的丧失,这进一步证明了GPX4在防止肾脏铁死亡中的关键作用。肾脏组织在GPX4失活后对铁死亡的敏感性增加,可能是由于肾脏的生理功能和细胞结构特点使其更容易受到氧化应激和铁离子的影响。这也进一步强调了GPX4在保护肾脏免受铁死亡损害中的重要作用。
总的来说,铁死亡与肾脏疾病之间存在密切的联系。了解这种关系有助于我们更好地理解肾脏疾病的发病机制,找到相应的治疗方案。
云克隆可提供上述研究中涉及到的肾缺血再灌注损伤(RIRI)动物模型。
肾缺血再灌注损伤(RIRI)大鼠模型
https://www.cloud-clone.com.cn/AnimalExperiments/Rat-Model-for-Renal-Ischemia-DSI529Ra01.html
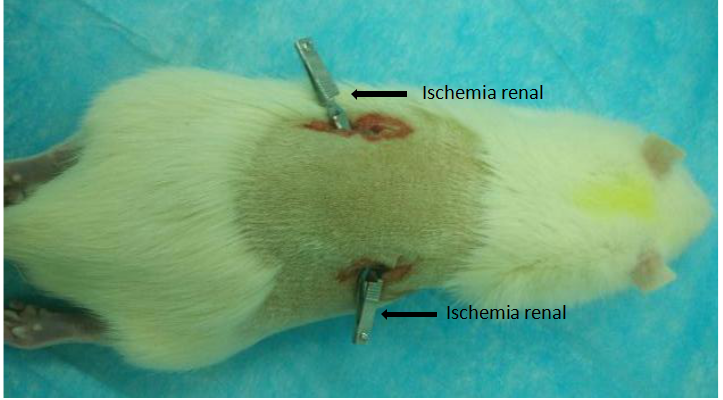
图2. 大鼠肾缺血再灌注手术
肾缺血再灌注损伤(RIRI)小鼠模型
https://www.cloud-clone.com.cn/AnimalExperiments/Mouse-Model-for-Renal-Ischemia-DSI529Mu01.html
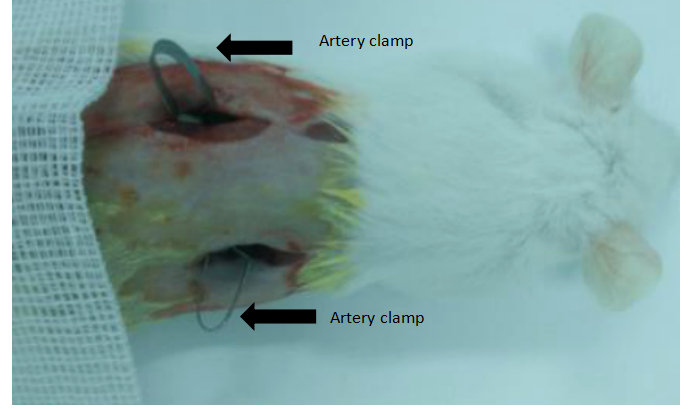
图3. 小鼠肾缺血再灌注手术
云克隆还开发了上述研究中涉及到的相关靶标产品的蛋白、抗体以及试剂盒产品。靶标及核心货号如下,供参考。